题目内容
下表是几种常见物质在不同温度时的溶解度
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
| Ca(OH)2 | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 | 0.13 | 0.12 | |
(1)根据表中的数据在图中画出NaCl和KNO3的溶解度曲线;
(2)根据上表和所绘制的溶解度曲线分析:
①下列说法不正确的有
A.硝酸钾的溶解度大于氯化钠的溶解度
B.0°C时各物质的溶解度都为0g
C.上述三种物质的溶解度都随温度的升高而增大
D.分别将它们的饱和溶液降温,只有Ca(OH)2溶液有晶体析出.
②55℃时,硝酸钾的溶解度约为________g.
③60℃时,将60g KNO3放人50g水中,充分搅拌,所得溶液的质量是________,该溶液的溶质质量分数为________.
④当KNO3中混有少量NaCl时,可采用________方法提纯KNO3.
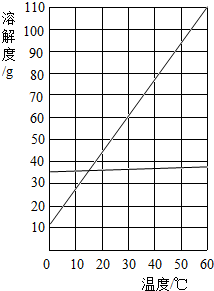 解:(1)由于固体的溶解度只受一个外界因素---温度的影响,因此氯化钠和硝酸钾的溶解度和温度间的关系如图所示(温度为横坐标,物质的溶解度为纵坐标)
解:(1)由于固体的溶解度只受一个外界因素---温度的影响,因此氯化钠和硝酸钾的溶解度和温度间的关系如图所示(温度为横坐标,物质的溶解度为纵坐标)(2)①根据三种物质的溶解度曲线可知,A、固体溶解度只受一个外界因素--温度的影响,没有说明温度,溶解度也就没有意义,故A错误;B、在0℃时,三种物质的溶解度都不为0,故B错误;C、由于硝酸钾的溶解度随温度的升高而明显增大,氯化钠的溶解度受温度的影响不大,氢氧化钙的溶解度随温度的升高而减小,故C错误;D、给它们的饱和溶液降温时,由于氢氧化钙的溶解度随温度的升高而减小,应是只有氢氧化钙荣也没有晶体析出,故D错误;故选ABCD.
②根据硝酸钾的溶解度曲线可知,在55℃时,硝酸钾的溶解度约是100克,故答案为:100
③由于在60℃时,硝酸钾的溶解度是110克,即在100克水中最多溶解110克硝酸钾,则在50克水中最多溶解55克硝酸钾,则形成的饱和溶液中溶质的质量分数为:
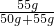 ×100%=52.4%,故答案为:52.4%
×100%=52.4%,故答案为:52.4%④由于硝酸钾的溶解度随温度的升高而明显增大,而氯化钠的溶解度受温度影响很小,因此提纯混有少量氯化钠的硝酸钾应采用降温结晶的方法,故答案为:降温结晶
分析:根据提供的数据即可找出固体的溶解度和温度间的关系;根据固体的溶解度曲线可以:①比较不同的固体物质在同一温度下的溶解度大小,②查出某固体物质在某温度下的溶解度,从而确定一定量的溶剂中能否溶解一定量的溶剂,形成的溶液是否饱和,③判断出固体物质的溶解度随温度变化的变化情况,从而确定从饱和溶液中使溶质析出的方法,及判断通过降温还是蒸发溶剂的方法达到提纯物质的目的.
点评:本题难度不是很大,主要考查了固体溶解度曲线表示的意义及根据固体的溶解度曲线来解决相关的问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下表是几种常见的元素,用相关元素完成下列问题.
①上表元素中,在地壳内含量最多的金属元素符号是 ,它与人体中含量最多的元素形成化合物的化学式为 ;水中含有的+1价的元素符号是 .
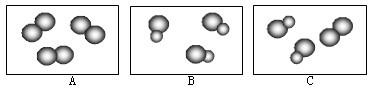
②如图表示气体分子示意模型,其中属于化合物的是 (填字母序号,下同),选用上表中元素,表示A图中的分子,其化学式可能为 (写出两种即可),并写出其中一种物质参加反应的化学方程式 .
| 元素名称 | 钠 | 铁 | 铝 | 氢 | 氯 | 氧 | 硫 |
②如图表示气体分子示意模型,其中属于化合物的是

下表是几种常见物质在不同温度时的溶解度
(1)根据表中的数据在图中画出NaCl和KNO3的溶解度曲线;
(2)根据上表和所绘制的溶解度曲线分析:
①下列说法不正确的有(ABCD )
A.硝酸钾的溶解度大于氯化钠的溶解度
B.0°C时各物质的溶解度都为0g
C.上述三种物质的溶解度都随温度的升高而增大
D.分别将它们的饱和溶液降温,只有Ca(OH)2溶液有晶体析出.
②55℃时,硝酸钾的溶解度约为 g.
③60℃时,将60g KNO3放人50g水中,充分搅拌,所得溶液的质量是 ,该溶液的溶质质量分数为 .
④当KNO3中混有少量NaCl时,可采用 方法提纯KNO3.
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
| Ca(OH)2 | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 | 0.13 | 0.12 | |

(2)根据上表和所绘制的溶解度曲线分析:
①下列说法不正确的有(ABCD )
A.硝酸钾的溶解度大于氯化钠的溶解度
B.0°C时各物质的溶解度都为0g
C.上述三种物质的溶解度都随温度的升高而增大
D.分别将它们的饱和溶液降温,只有Ca(OH)2溶液有晶体析出.
②55℃时,硝酸钾的溶解度约为
③60℃时,将60g KNO3放人50g水中,充分搅拌,所得溶液的质量是
④当KNO3中混有少量NaCl时,可采用
下表是几种常见物质在不同温度时的溶解度
(1)根据表中的数据在图中画出NaCl和KNO3的溶解度曲线;
(2)根据上表和所绘制的溶解度曲线分析:
①下列说法不正确的有(ABCD )
A.硝酸钾的溶解度大于氯化钠的溶解度
B.0°C时各物质的溶解度都为0g
C.上述三种物质的溶解度都随温度的升高而增大
D.分别将它们的饱和溶液降温,只有Ca(OH)2溶液有晶体析出.
②55℃时,硝酸钾的溶解度约为 g.
③60℃时,将60g KNO3放人50g水中,充分搅拌,所得溶液的质量是 ,该溶液的溶质质量分数为 .
④当KNO3中混有少量NaCl时,可采用 方法提纯KNO3.
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | ||
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
| Ca(OH)2 | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 | 0.13 | 0.12 | |
(2)根据上表和所绘制的溶解度曲线分析:
①下列说法不正确的有(ABCD )
A.硝酸钾的溶解度大于氯化钠的溶解度
B.0°C时各物质的溶解度都为0g
C.上述三种物质的溶解度都随温度的升高而增大
D.分别将它们的饱和溶液降温,只有Ca(OH)2溶液有晶体析出.
②55℃时,硝酸钾的溶解度约为 g.
③60℃时,将60g KNO3放人50g水中,充分搅拌,所得溶液的质量是 ,该溶液的溶质质量分数为 .
④当KNO3中混有少量NaCl时,可采用 方法提纯KNO3.

下表是几种常见物质在不同温度时的溶解度
(1)根据表中的数据在图中画出NaCl和KNO3的溶解度曲线;
(2)根据上表和所绘制的溶解度曲线分析:
①下列说法不正确的有(ABCD )
A.硝酸钾的溶解度大于氯化钠的溶解度
B.0°C时各物质的溶解度都为0g
C.上述三种物质的溶解度都随温度的升高而增大
D.分别将它们的饱和溶液降温,只有Ca(OH)2溶液有晶体析出.
②55℃时,硝酸钾的溶解度约为 g.
③60℃时,将60g KNO3放人50g水中,充分搅拌,所得溶液的质量是 ,该溶液的溶质质量分数为 .
④当KNO3中混有少量NaCl时,可采用 方法提纯KNO3.
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | ||
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
| Ca(OH)2 | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 | 0.13 | 0.12 | |
(2)根据上表和所绘制的溶解度曲线分析:
①下列说法不正确的有(ABCD )
A.硝酸钾的溶解度大于氯化钠的溶解度
B.0°C时各物质的溶解度都为0g
C.上述三种物质的溶解度都随温度的升高而增大
D.分别将它们的饱和溶液降温,只有Ca(OH)2溶液有晶体析出.
②55℃时,硝酸钾的溶解度约为 g.
③60℃时,将60g KNO3放人50g水中,充分搅拌,所得溶液的质量是 ,该溶液的溶质质量分数为 .
④当KNO3中混有少量NaCl时,可采用 方法提纯KNO3.
