��Ŀ����
����Ŀ��Ǧ������������������ʹ�ù㷺���乹��ʾ��ͼ��ͼ1���ش��������⣺
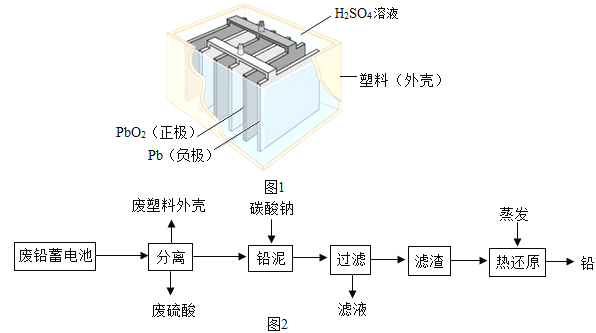
��1��Ǧ���س��ʱ�ǽ�����ת��Ϊ___________������ţ�
a����е�� b������ c����ѧ��
��2��Ǧ���طŵ�����У���Ӧ�Ļ�ѧ����ʽΪPb+PbO2+2H2SO4�T2PbSO4+2H2O���ݴ˿�֪��Ǧ�����ڷŵ�ʱ����Һ��pH����___________�����������С�����䡱����
��3����ͼ2�ǻ��շ�Ǧ���ص�һ�ֹ������̣�
�ٴӲ��Ϸ���Ƕȿ���������һ��___________���ϣ�
�ڷ�������������ʯ[Ca5��PO4��3F]��Ӧ����Ӧ�Ļ�ѧ����ʽΪ2Ca5��PO4��3F+7H2SO4�T3CaSO4+3Ca��H2PO4��2+2HF����Ӧ�����п��������ʵ�������___________��
�������һЩ�����۵�����ݣ�
���� | �� | Ǧ | �� | �� |
�۵�M�� | 231.9 | 327.5 | 271.3 | 320.9 |
�ճ����ñ���˿���顢Ǧ�������ӵȽ�����ɣ����۵�ԼΪ___________������ţ�
A��300��320�� B��230��250�� C��60��80�� D��20��40��
�ܷ�����ֱ���ŷŻ���Ⱦ��������ѡ����������кͺ����ŷţ�
���� | CaCO3 | Ca(OH)2 | NH3 | NaOH |
�г��ο��ۣ�Ԫ/kg �� | 1.8 | 2.0 | 6.5 | 11.5 |
��֪��2NH3+H2SO4�T��NH4��SO4�����Ҫ�����ٵ�Ǯ���к͵���������Ũ�ȵķ����ᣬ��Ӧѡ��___________������ţ���
a��CaCO3 b��Ca(OH)2 c��NH3 d��NaOH
���𰸡���1��c����2������3�����л��ϳɣ���Ca(H2PO4)2����C����4��b��
��������
�����������1��Ǧ����Ҳ�ǻ�ѧ��أ��ڳ��ʱ�����ĵ��ܣ��õ���ѧ�ܣ��ʳ��ʱ������ת��Ϊ��ѧ�ܣ�
��2����Ǧ���ص��ܷ�ӦPbO2+2H2SO4+Pb�T2PbSO4+2H2O��֪�����ᱻ���ģ��������Լ�����pH��������
��3���ٴӲ��Ϸ���Ƕȿ���������һ���л��ϳɲ��ϣ��ڷ�������������ʯ[Ca5(PO4)3F]��Ӧ����Ӧ�Ļ�ѧ����ʽΪ2Ca5(PO4)3F+7H2SO4�T3CaSO4+3 Ca(H2PO4)2+2HF����Ӧ�����п��������ʵ�������Ca(H2PO4)2���۱���˿���۵㲻�ܹ��ߣ����������������ã�����̫����������۶ϣ���Ϊ60��80����ã�������B��
��4��
CaCO3+H2SO4�TCaSO4+H2O+CO2��
100 98
Ca(OH)2+H2SO4�TCaSO4+2H2O
74 98
2NH3+H2SO4�T(NH4)2SO4
34 98
2NaOH+H2SO4�TNa2SO4+2H2O
80 98
���綼�Ǵ������������Ϊ98Kg������Ҫ̼��Ƶ�Ǯ��Ϊ100Kg��1.8Ԫ/Kg=180Ԫ����Ҫ�������Ƶ�Ǯ��Ϊ74Kg��2.0Ԫ/Kg=148Ԫ����Ҫ������Ǯ��Ϊ34Kg��6.5Ԫ/Kg=221Ԫ����Ҫ�������Ƶ�Ǯ��Ϊ80Kg��11.5Ԫ/Kg=920Ԫ��ʹ�������������õ�Ǯ��������ѡ����b��