题目内容
随着人民生活水平的提高,食品安全问题倍受社会关注.苯甲酸是常见的食品防腐剂.它是一种片状晶体,在水中的溶解度如下表:
某研究性学习小组要确定苯甲酸的组成,现有苯甲酸样品(含泥沙等难溶于水的杂质),实验步骤如下:
(1)提纯苯甲酸:室温下,取样品约10g放入大烧杯中,加入500mL蒸馏水充分搅拌,发现样品几乎没溶解,原因是
(2)化学组成分析(苯甲酸中一定含有C、H元素,可能含有氧元素)
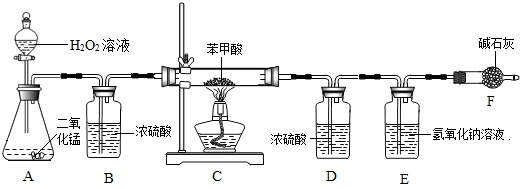
①仪器A中所发生的反应化学方程式为
②仪器B的作用是
③实验结束后发现装置D增重2.7g,装置E增重15.4g,试通过计算确定苯甲酸中
| 温度 | 25℃ | 50℃ | 95℃ |
| 溶解度 | 0.17g | 0.95g | 6.8g |
(1)提纯苯甲酸:室温下,取样品约10g放入大烧杯中,加入500mL蒸馏水充分搅拌,发现样品几乎没溶解,原因是
室温时,苯甲酸的溶解度较小
室温时,苯甲酸的溶解度较小
,将烧杯放在石棉网上加热,将样品充分溶解后,在加入少量蒸馏水,然后趁热过滤.趁热过滤的目的是减少过滤时苯甲酸的损失
减少过滤时苯甲酸的损失
,将所得滤液缓慢冷却至室温
缓慢冷却至室温
,使苯甲酸以晶体形式析出,然后过滤得到较纯净的苯甲酸晶体6.1g.(2)化学组成分析(苯甲酸中一定含有C、H元素,可能含有氧元素)

①仪器A中所发生的反应化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
②仪器B的作用是
干燥氧气
干燥氧气
.③实验结束后发现装置D增重2.7g,装置E增重15.4g,试通过计算确定苯甲酸中
含有
含有
氧元素(填“含有”或“不含有”),苯甲酸的化学式为C7H6O2
C7H6O2
.分析:(1)利用表格提供的不同温度下的溶解度解释此题.温度低时苯甲酸溶解度很低,易析出过滤会使其损失.为使其形成颗粒较大的晶体,应缓慢降温;
(2)①根据过氧化氢溶液在二氧化锰的催化作用下分解的反应,写出反应的方程式;
②根据浓硫酸具有吸水性分析;
③根据反应的流程图,分析生成的二氧化碳和水的质量,根据质量守恒定律分析苯甲酸的组成元素的质量,并由相对原子质量求出各元素的原子个数比,写出化学式.
(2)①根据过氧化氢溶液在二氧化锰的催化作用下分解的反应,写出反应的方程式;
②根据浓硫酸具有吸水性分析;
③根据反应的流程图,分析生成的二氧化碳和水的质量,根据质量守恒定律分析苯甲酸的组成元素的质量,并由相对原子质量求出各元素的原子个数比,写出化学式.
解答:解:(1)苯甲酸的溶解度随温度升高而增大,25℃时其溶解度只有0.17g,室温时会更小.所以,室温时苯甲酸几乎没溶解的原因是:苯甲酸的溶解度较小.温度低时苯甲酸溶解度很低,易析出,过滤会使其与泥沙混合滤出导致其损失.所以,趁热过滤的目的是:减少过滤时苯甲酸的损失.缓慢降温使其析出会得到颗粒较大的晶体,便于得到苯甲酸晶体;
(2)①过氧化氢溶液在二氧化锰的催化作用下分解,生成了水和氧气,反应的方程式是:2H2O2
2H2O+O2↑;②由于浓硫酸具有吸水性,所以,仪器B的作用是干燥氧气;
③由于浓硫酸具有吸水性,装置D增重2.7g是生成的水的质量,氢元素的质量为:2.7g×
×100%=0.3g;由于氢氧化钠溶液能吸收二氧化碳,装置E增重15.4g即是生成二氧化碳的质量.碳元素的质量为:15.4g×
×100%=4.2g;由质量守恒定律可知,苯甲酸中含有碳、氢元素的质量分别为4.2g、0.3g,由于4.2g+0.3g=4.5g>6.1g,所以,苯甲酸中含有氧元素.苯甲酸中碳、氢、氧元素的原子个数比为:
:
:
=7:6:2,所以,苯甲酸的化学式是:C7H6O2.
故答为:(1)室温时,苯甲酸的溶解度较小;减少过滤时苯甲酸的损失;缓慢冷却至室温;(2)①2H2O2
2H2O+O2↑;②干燥氧气;③含有,C7H6O2.
(2)①过氧化氢溶液在二氧化锰的催化作用下分解,生成了水和氧气,反应的方程式是:2H2O2
| ||
③由于浓硫酸具有吸水性,装置D增重2.7g是生成的水的质量,氢元素的质量为:2.7g×
| 1×2 |
| 1×2+16 |
| 12 |
| 12+16×2 |
| 4.2g |
| 12 |
| 0.3g |
| 1 |
| 6.1g-4.5g |
| 16 |
故答为:(1)室温时,苯甲酸的溶解度较小;减少过滤时苯甲酸的损失;缓慢冷却至室温;(2)①2H2O2
| ||
点评:此题是利用物质的溶解度对混合物进行分离,利用表格数据结合相关的实验操作解决此题.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
哥本哈根气候大会主要议题是二氧化碳排放问题,上海世博会也大力倡导“低碳”生活理念.随着人民生活水平的提高,家庭小轿车的数量不断增加,这些汽车燃料燃烧时向大气中排放了大量的二氧化碳.汽车所用燃料主要是汽油,汽油的成分复杂,同甲烷(CH4)替代汽油进行计算(含碳量比汽油略低).公共汽车和小轿车耗油量(均以汽油为燃料)和载客人数如下:
请计算:乘公共汽车行驶一百公里,人均排放二氧化碳______kg;乘小汽车行驶相同距离,人均排放二氧化碳的质量是乘公共汽车的______倍.通过计算,谈谈为实现“低碳”生活理念,你的做法是什么?(答出两点即可)
| 公共汽车 | 小轿车 | |
| 百公里耗油量/kg | 18 | 9 |
| 平均载客人数/人 | 30 | 2 |