题目内容
【题目】下图为实验室常用的实验装置。回答问题: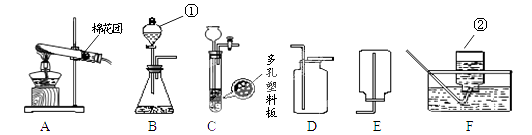
(1)标号仪器的名称:①;②。
(2)A、F组合制氧气,氧气收集完毕,应先(填“熄灭酒精灯”或“从水中取出导气管”)。
(3)用B、D组合制取气体的化学反应方程式。
若将发生装置由B改为C,其优点是。
(4)硫化氢气体(H2S)有毒,溶于水形成酸。用块状硫化亚铁(FeS)和稀硫酸发生复分解
反应制得H2S,反应化学方程式为。某同学用下图G、H 、I组合收集H2S。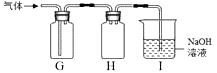
①G收集H2S,说明其密度比空气(填“大”或“小”)。
②各装置的作用:H、I。
【答案】
(1)分液漏斗,集气瓶
(2)从水中取出导气管
(3)2H2O2 ![]() 2H2O + O2↑或CaCO3 + 2HCl = CaCl2+ H2O + CO2↑,使反应随时发生或停止,使用方便
2H2O + O2↑或CaCO3 + 2HCl = CaCl2+ H2O + CO2↑,使反应随时发生或停止,使用方便
(4)FeS+H2SO4=FeSO4+H2S↑,大,防止液体倒吸(或缓冲),吸收多余的H2S(或预防H2S污染大气).
【解析】(1)依据常见仪器可知,①分液漏斗;②集气瓶;
(2)先熄灭酒精灯,会使A装置中温度降低,压强减少,水槽中的水会倒流进热的试管,使试管炸裂,故氧气收集完毕,应先从水中取出导气管;
(3)用B、D组合制取的气体密度应比空气大,故可选制氧气或二氧化碳:2H2O2 ![]() 2H2O + O2↑或CaCO3 + 2HCl = CaCl2+ H2O + CO2↑ ;若将发生装置由B改为C,由于弹簧夹和多孔塑料板的作用,装置的优点是:使反应随时发生或停止,使用方便;
2H2O + O2↑或CaCO3 + 2HCl = CaCl2+ H2O + CO2↑ ;若将发生装置由B改为C,由于弹簧夹和多孔塑料板的作用,装置的优点是:使反应随时发生或停止,使用方便;
(4)依据题意可得:硫化亚铁;(FeS)和硫酸相互交换成分,生成H2S气体和硫酸亚铁:FeS+H2SO4=FeSO4+H2S↑;①中因为气体是从长管进,说明H2S密度比空气大;②H装置中两管都短,能防止液体倒吸(或缓冲)、I装置的作用是吸收多余的H2S,防止污染空气.
所以答案是:
(1)分液漏斗;集气瓶;
(2)从水中取出导气管;
(3)2H2O2 ![]() 2H2O + O2↑或CaCO3 + 2HCl = CaCl2+ H2O + CO2↑ ;使反应随时发生或停止,使用方便;
2H2O + O2↑或CaCO3 + 2HCl = CaCl2+ H2O + CO2↑ ;使反应随时发生或停止,使用方便;
(4)FeS+H2SO4=FeSO4+H2S↑;大;能防止液体倒吸(或缓冲);吸收多余的H2S(或预防H2S污染大气).

 阅读快车系列答案
阅读快车系列答案