题目内容
2.8克铁入20克盐酸中,恰好完全反应,计算:
(1)原盐酸溶液中溶质的质量分数
(2)反应后所得溶液中溶质的质量分数.
(1)原盐酸溶液中溶质的质量分数
(2)反应后所得溶液中溶质的质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:根据铁的质量可以计算反应的氯化氢的质量、生成氯化亚铁的质量和氢气的质量,进一步可以计算原盐酸溶液中溶质的质量分数和反应后所得溶液中溶质的质量分数.
解答:解:(1)设稀盐酸中氯化氢的质量为x,反应生成的氯化亚铁质量为y,生成氢气的质量为z,
Fe+2HCl═FeCl2+H2↑,
56 73 127 2
2.8g x y z
=
=
=
,
x=3.65g,y=6.35g,z=0.1g,
原盐酸溶液中溶质的质量分数为:
×100%=18.25%,
答:原盐酸溶液中溶质的质量分数为18.25%.
(2)反应后所得溶液中溶质的质量分数为:
×100%=27.97%,
答:反应后所得溶液中溶质的质量分数为27.97%.
Fe+2HCl═FeCl2+H2↑,
56 73 127 2
2.8g x y z
| 56 |
| 2.8g |
| 73 |
| x |
| 127 |
| y |
| 2 |
| z |
x=3.65g,y=6.35g,z=0.1g,
原盐酸溶液中溶质的质量分数为:
| 3.65g |
| 20g |
答:原盐酸溶液中溶质的质量分数为18.25%.
(2)反应后所得溶液中溶质的质量分数为:
| 6.35g |
| 2.8g+20g-0.1g |
答:反应后所得溶液中溶质的质量分数为27.97%.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
推理是化学学习中常用的思维方法,下列推理正确的是( )
| A、氧化钙溶于水使水温升高,所以能使水温升高的物质一定是氧化钙 |
| B、NaOH溶液中的OH-能与酸反应,则KOH溶液中的OH-也能与酸反应 |
| C、碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐 |
| D、盐是由金属离子和酸根离子构成的,NH4NO3中没有金属离子,不属于盐 |
下列各组微粒中含质子数和电子数都相同的一组是( )
| A、Na和Al |
| B、NH3和H2O |
| C、Al3+和Ne |
| D、S2-和Cl- |
下列化学反应,属于化合反应的是( )
A、碳+氧气
| ||
| B、氢氧化钠+硫酸铜→氢氧化铜+硫酸铜 | ||
| C、锌+稀硫酸→氯化锌+氢气 | ||
D、水
|
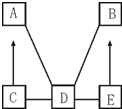 A、B、C、D、E是初中化学中常见的不同类别的物质(物质按单质、氧化物、酸、碱、盐分类).已知A是单质;C是红棕色固体;E是水溶液可使酚酞试液变为红色的盐.图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质(部分反应物、生成物及反应条件已略去).回答下列问题:
A、B、C、D、E是初中化学中常见的不同类别的物质(物质按单质、氧化物、酸、碱、盐分类).已知A是单质;C是红棕色固体;E是水溶液可使酚酞试液变为红色的盐.图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质(部分反应物、生成物及反应条件已略去).回答下列问题: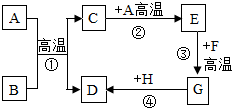 A~H都是初中化学中常见的物质,已知A为黑色非金属固体单质,B为黑色氧化物固体,C能使澄清石灰水变浑浊,D为红色固体单质,F为铁锈的主要成分,它们的转化关系如图所示.请回答:
A~H都是初中化学中常见的物质,已知A为黑色非金属固体单质,B为黑色氧化物固体,C能使澄清石灰水变浑浊,D为红色固体单质,F为铁锈的主要成分,它们的转化关系如图所示.请回答: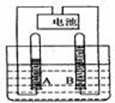 如图是电解水实验的示意图
如图是电解水实验的示意图