题目内容
【题目】元素周期表是学习和研究化学的重要工具.下表是元素周期表中的一部分,请按表中信息填空: 
(1)原子序数为6的元素在上表中的位置应是(填①、②、③或④);
(2)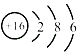 是元素的原子结构示意图,它属于(填“金属”或“非金属”)元素.该原子在化学反应中易电子(填“得到”或“失去”);形成的离子符号为 .
是元素的原子结构示意图,它属于(填“金属”或“非金属”)元素.该原子在化学反应中易电子(填“得到”或“失去”);形成的离子符号为 .
(3)原子序数为11的元素与第二周期中的(填名称)元素具有相似的化学性质.
(4)写出原子序数为13的元素形成的氧化物的化学式 .
(5)M2+与Ne核外电子排布相同,则M元素的名称为 , 已知M元素的相对原子质量为a,则M元素原子核内的中子数近似为 .
【答案】
(1)①
(2)硫;非金属;得到;S2﹣
(3)锂
(4)Al2O3
(5)氧;a﹣8
【解析】解:(1)原子序数是元素周期表按元素原子核电荷数递增的顺序给元素编的号,原子序数与元素原子核电荷数在数值上相同,则原子序数为6的元素在上表中的位置应是①.故填:①;(2)由原子结构示意图为可以看出:圆圈内的数字是16,该元素原子核内有16个质子;由原子序数=核电荷数=质子数,则该元素的原子序数为16,为硫元素,属于非金属元素.最外层电子数是6,在化学反应中易得到2个电子而形成阴离子﹣﹣硫离子;故填:硫;非金属;得到;S2﹣;(3)元素周期表中同一纵行具有相同的最外层电子数,化学性质相似,与钠元素位于同一纵行,又位于第二周期的元素是锂;故填:锂;(4)13号元素是铝元素,化合价为+3价,氧元素显﹣2价,二者组成的化合物的化学式为Al2O3;故填:Al2O3;(5)M2﹣是由M原子得到2个电子形成的,其核外有10个电子,则M核外有8个电子,核电荷数为8,是氧元素;因为相对原子质量=质子数+中子数,所以氧原子核内的中子数为:a﹣8.故填:氧;a﹣8.
(1)根据题意,原子序数是元素周期表按元素原子核电荷数递增的顺序给元素编的号,原子序数与元素原子核电荷数在数值上相同,据此进行分析解答;(2)由原子结构示意图为可以看出:圆圈内的数字是16,该元素原子核内有16个质子,结合若原子的最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子,进行分析解答;(3)根据决定元素化学性质的主要因素来分析;(4)根据氧化物的化学式写法来分析;(5)根据微粒的结构以及相对原子质量=质子数+中子数来分析.