题目内容
中和反应是中学化学中重要的学习内容,其在日常生活和工农业生产中有广泛的应用.下图表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线.请从曲线图中获取信息,回答下列问题:
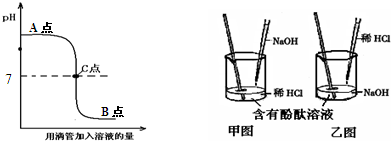
(1)实验操作是按照以上
(2)C点表示
(3)用溶质的质量分数为36.5%的盐酸40g与足量氢氧化钠溶液恰好完全反应,需要溶质的质量分数为20%的氢氧化钠溶液

(1)实验操作是按照以上
乙
乙
(甲或乙)图所示进行,烧杯中溶液的颜色由红
红
色逐渐变为无
无
色.(2)C点表示
盐酸和氢氧化钠刚好完全中和,此时溶液pH为7
盐酸和氢氧化钠刚好完全中和,此时溶液pH为7
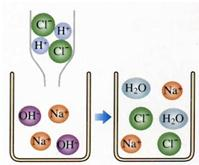
.从A点到C点的过程中,溶液中大量存在的离子有Na+、Cl-、OH-
Na+、Cl-、OH-
;从C点到B点的过程中,溶液中大量存在的离子有Na+、Cl-、H+
Na+、Cl-、H+
;(3)用溶质的质量分数为36.5%的盐酸40g与足量氢氧化钠溶液恰好完全反应,需要溶质的质量分数为20%的氢氧化钠溶液
80
80
g.分析:氢氧化钠溶液呈碱性,其PH大于7,盐酸呈酸性,其PH小于7,氢氧化钠溶液和盐酸可以发生中和反应生成氯化钠和水,恰好完全反应时其PH等于7,氢氧化钠过量时显碱性,盐酸过量时显酸性.酚酞在碱性溶液中为红色,在中性和酸性溶液中为无色.
解答:解:(1)由图象可以看出,开始时溶液的PH大于7,呈碱性,表明是向氢氧化钠溶液中加入的盐酸,酚酞在碱性溶液中为红色,在中性和酸性溶液中为无色,所以本题答案为:乙;红;无色;
(2)C点对应的PH等于7,表明二者恰好完全反应,向氢氧化钠溶液中加入的盐酸,从A点到C点的过程中,氢氧化钠溶液和盐酸可以发生中和反应生成氯化钠和水,氢氧化钠相对于盐酸过量,溶液组成为剩余的氢氧化钠和生成的氯化钠;从C点到B点的过程中,盐酸过量,溶液组成为生成的氯化钠和剩余的盐酸,所以本题答案为:盐酸和氢氧化钠刚好完全中和,此时溶液pH为7(答案合理即可);Na+、Cl-、OH-;Na+、Cl-、H+;
(3)设需要溶质的质量分数为20%的氢氧化钠溶液质量为x,
HCl+NaOH═NaCl+H2O
36.5 40
40g×36.5% x×20%
=
x=80g
答:需要溶质的质量分数为20%的氢氧化钠溶液80g.
故答案为:80.
(2)C点对应的PH等于7,表明二者恰好完全反应,向氢氧化钠溶液中加入的盐酸,从A点到C点的过程中,氢氧化钠溶液和盐酸可以发生中和反应生成氯化钠和水,氢氧化钠相对于盐酸过量,溶液组成为剩余的氢氧化钠和生成的氯化钠;从C点到B点的过程中,盐酸过量,溶液组成为生成的氯化钠和剩余的盐酸,所以本题答案为:盐酸和氢氧化钠刚好完全中和,此时溶液pH为7(答案合理即可);Na+、Cl-、OH-;Na+、Cl-、H+;
(3)设需要溶质的质量分数为20%的氢氧化钠溶液质量为x,
HCl+NaOH═NaCl+H2O
36.5 40
40g×36.5% x×20%
| 36.5 |
| 40g×36.5% |
| 40 |
| x×20% |
x=80g
答:需要溶质的质量分数为20%的氢氧化钠溶液80g.
故答案为:80.
点评:本题以图象的形式考查了酸碱中和反应时溶液PH的变化以及物质间的质量关系,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
 :
: :
:
