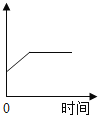
��Ŀ����
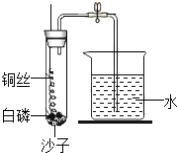
����Ŀ��ijͬѧ����˲ⶨ����������������ʵ�飬ʵ��װ����ͼ����ͬѧ��ʵ�鲽�����£�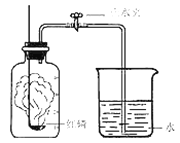
�ٽ�ͼ�еļ���ƿ��Ϊ5�ȷݣ������ñ�ǡ�
���ڴ���Ƥ���͵��ܵ�ȼ�ճ���װ�������ĺ��ף��������ϵ�ֹˮ�мн����ھƾ����ϵ�ȼ���ף����������뼯��ƿ�ڣ�������Ƥ����
�۳�ַ�Ӧ������ƿ��ȴ�����£���ֹˮ�С�
��ش��������⣺
��1����ʵ���к������Թ�����Ŀ����_________________��
��2��������д�ֹˮ�к�۲쵽��������________________��
�ɴ˿ɵó��������������������ԼΪ_______________���ɱ�ʵ�黹����֪��������Щ���ʣ���д��һ�֣�______________________________��
��3������������ľ̿����ʵ���ܷ��óɹ�_______����ܡ�����������_____________��
���𰸡�ʹ�����е�����ȫ��������ˮ�ص��ܽ��뼯��ƿ����ռ�ݻ���1/520%����������ˮ������֧��ȼ�շ�ľ̿ȼ�պ������˶�����̼����
��������
��1����ʵ���к������Թ�������Ŀ���ǽ������е�����ȫ�����ģ�
��2�����������ĺ�ƿ����ѹС��������ѹ���ʴ�ֹˮ�к�۲쵽ˮ�ص��ܽ��뼯��ƿ�У���������Լռ������������֮һ���ʽ���ˮ�����ռ����ƿ�ݻ���1/5���ɴ˿ɵó��������������������ԼΪ20%�����������ĺ���֪������������������ˮ����֧��ȼ�գ�
��3������������ľ̿��������Ϊ���������̼���������ѹǿ��ʸ�ʵ�鲻�ܻ�óɹ���

 �Ķ��쳵ϵ�д�
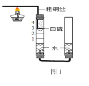
�Ķ��쳵ϵ�д�����Ŀ��̽��һ����������������������Լռ_________%��һ�Ż�ѧ��ȤС���ͬѧ���տα���ʵ��װ�������ⶨ���������������������ʵ�飬����������������������ƫС����ƸĽ�ʵ�飨ͼ1��
���������ϣ�
��ɫ��״̬ | �۵�/�� | ȼ����������¶�/�� | �ܶ�/gcm��3 | |
���� | ����ɫ���� | 590 | 240 | 2.34 |
���� | ��ɫ���� | 44.1 | 40 | 1.82 |
��1��д���α�ʵ�鼯��ƿ�к�������Ӧ�����ֱ���ʽ____________������_____��Ӧ��
��2���α�ʵ���������������ƫС��ԭ���У�_____________��__________��
��3���Կα�ʵ��װ�ý�������ͼ1�ĸĽ���
�ٰѺ�����Ϊ���ף�������______________________________��
��ͨ����ͭ˿����ȼ�������ڵİ��ף������˽���ͭ��_____�ԣ�
����α�ʵ��װ����ȣ�ͼ1װ�õ�һ���ŵ���_________________��
̽���������Ż�ѧ��ȤС�������ͼ2��ʾ��װ�ã�̽���������������������������A�ǵ����Ϊ50cm2����20 cm��ԲͲ״��������(���ܷ��)�����������cmΪ��λ�Ŀ̶ȣ�B�Ǵ��̶ȵij��ڲ�����(��������װ����)�����ǵIJ����������£�
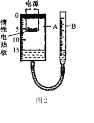
a�����װ�������ԣ�b.��ˮ������B�ĸ߶ȣ�ʹA�е�Һ�����̶�15 cm����
c����������ͭ��ƽ���ڶ��Ե��Ȱ��ϣ��ǽ��ܷ�ǡ�����ʾ��ͭ�������ڼ��ȵ������·�Ӧ��������ͭ��
d��ͨ�����ͭ�ۣ�����ַ�Ӧ����ȴ��ԭ����״��������B�ĸ߶�ʹ����A��B�е�Һ�汣��ˮƽ����¼Һ��̶ȡ�(ע��A�����ڹ�̬������ռ��������Բ���)
(1)�ڲ���a�м��װ�������Եķ�������B�м�ˮ��ʹA��BҺ�汣��ˮƽ���ǽ�A���ܷ�ǣ���������סA����ڣ���B�е�Һ����������������___����á����á���
(2)������ʵ���У��������ʲ��ܴ���ͭ�۵���________(����ĸ)��
A������ B��ľ̿ C����
(3)�ڲ���d����ʱ��װ��A��Һ��Ŀ̶�ԼΪ________cm(������)������ڲ���d����ʱ��װ��A��Һ��̶���11cm������ʵ����������ֵ________(�ƫ��ƫС��)��
����Ŀ�����������£���һ���ܱյ������������·�Ӧ����Ӧ���������β�ø����ʵ����������ʾ��
���� | P | Q | R | W | ||||
��һ�β�õ�����/g | 40 | 4 | 3.6 | 4.8 | ||||
�ڶ��β�õ�����/g | ���� | 13 | 12.6 | 10.8 | ||||
�� | A�� | ������ѧ��Ӧ����ʽһ��ΪP | ||||||
�� | B�� | �÷�ӦR��W�������仯֮��Ϊ2��3 | ||||||
�� | C�� | ���βⶨ֮������W������Ϊ10.8g | ||||||
�� | D�� | �ڶ��β��P������Ϊ16g | ||||||