题目内容
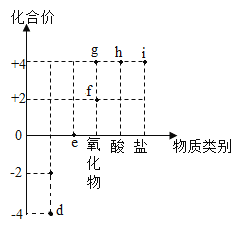
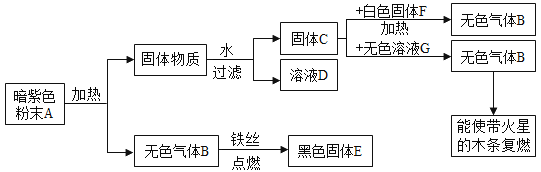
【题目】Ⅰ、A~H 都是初中化学中常见物质,已知 A、B 皆为黑色固体,D 为红色固体的单质,F 为红色固体的化合物,它们的转化关系如图所示。

(1)C 物质的化学式是________,举一例 E 在生产、生活中的用途_____。
(2)反应④的化学方程式为____________。
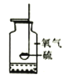
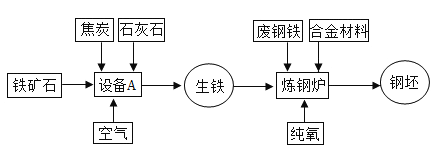
Ⅱ、下图是炼铁和炼钢示意图。
(1)合金材料属于___________(填“纯净物”或“混合物”) 。
(2)炼钢炉中通入纯氧的目的是降低生铁中___________的含量。
(3)设备 A 中以磁铁矿(Fe3O4)为原料炼得生铁的化学方程式为______________。
【答案】CO2 冶炼金属、作燃料 ![]() 混合物 碳
混合物 碳 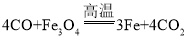
【解析】
A、B为黑色固体,D 为红色固体的单质,则D是铜; A和B高温生成C和D,C和A高温生成E,氧化铜与碳在高温条件下生成铜和二氧化碳,碳与二氧化碳在高温条件下生成一氧化碳,则A是C,B是氧化铜,C是二氧化碳,E是一氧化碳;E和F生成G,F 为红色固体的化合物,F是氧化铁,氧化铁与一氧化碳在高温条件下生成铁和二氧化碳,G是铁;G和H生成D,铁与硫酸铜反应生成铜和硫酸亚铁,则H可能是硫酸铜。将推理代入框图,推理成立。
根据以上分析可知:
Ⅰ(1)C 物质的化学式是CO2,一氧化碳具有还原性,可以冶炼金属,一氧化碳具有可燃性,可用来作燃料,故E 在生产、生活中的用途是冶炼金属、作燃料;
(2)反应④是铁和硫酸铜生成硫酸亚铁和铜,反应的化学方程式为:![]() ;
;
Ⅱ(1)合金是由金属和金属或金属与非金属熔合而成的具有金属特性的物质,合金材料含有多种物质,故属于混合物。
(2)碳在氧气中点燃生成二氧化碳,故炼钢炉中通入纯氧的目的是降低生铁中碳的含量。
(3)设备 A 中以磁铁矿(Fe3O4)为原料炼得生铁的反应是一氧化碳和四氧化三铁高温生成铁和二氧化碳,反应的化学方程式为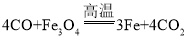 。
。

【题目】为测定硫酸钠和硫酸镁固体混合物中硫酸镁的质量分数。某同学取固体混合物26.2g,向其中加入219.6g水,使其完全溶解配制成混合溶液。将200g一定溶质质量分数的氢氧化钠溶液平均分成5等份,依次加入到上述混合溶液中,生成沉淀的质量与加入氢氧化钠溶液的质量关系如下表:
次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
氢氧化钠溶液质量/g | 40 | 40 | 40 | 40 | 40 |
产生沉淀质量/g | 1.45 | 2.9 | m | 5.8 | 5.8 |
试分析计算。
(1)m的值为_____。
(2)固体混合物中硫酸镁的质量分数。_____(结果保留0.1%)
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数。_____