题目内容
某不纯的镁2.4g与足量稀硫酸完全反应后产生氢气0.22g,则其所含杂质可能为( )
| A.Cu | B.C | C.Al | D.Zn |
铜在金属活动顺序表中排在氢的后面,说明铜不能与稀硫酸反应,因此排除选项A.
C不与稀硫酸反应不能产生氢气,因此排除选项B.
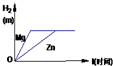
由于镁、铝、锌的相对原子质量由小到大的顺序是:镁<铝<锌,因此等质量的镁、铝、锌、铁与稀硫酸反应时产生的氢气质量由多到少的顺序是:铝>镁>锌.根据:氢气的质量=
×金属的质量,因为0.2g<0.22g,说明等质量的镁和杂质与稀硫酸反应时杂质产生的氢气多.结合上述分析说明杂质为铝.
故选:C.
C不与稀硫酸反应不能产生氢气,因此排除选项B.
由于镁、铝、锌的相对原子质量由小到大的顺序是:镁<铝<锌,因此等质量的镁、铝、锌、铁与稀硫酸反应时产生的氢气质量由多到少的顺序是:铝>镁>锌.根据:氢气的质量=
| 金属的化合价 |
| 金属的相对原子质量 |
故选:C.

练习册系列答案
相关题目