题目内容
【题目】为测定某赤铁矿石中氧化铁的质量分数,用足量的一氧化碳与6.0g赤铁矿石样品充分反应(杂质不参与反应),反应前后盛装赤铁矿石的玻璃管总质量与反应时间的变化关系如图。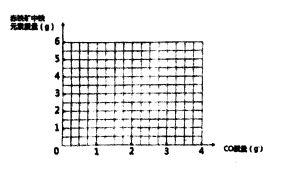
(1)消耗一氧化碳的质量为g。
(2)计算赤铁矿石中氧化铗的质量分数(保留两位小数)。
(3)中画出赤铁矿中铁元素质量随—氧化碳的通入量两变化的曲线:
【答案】
(1)2.1g
(2)解:由图中计算可知反应前后玻璃管质量的变化(56.0-54.8)g=1.2g即氧化铁转化为铁失去的氧元素的质量,由此可算出参加反应的CO的质量为2.1g。
设赤铁矿中氧化铁的质量为x,
3CO+ | Fe2O3 |
84 | 160 |
2.1g | x |
160:x=(3×28):21 得x=4g
赤铁矿氧化铁的质量分数为: ![]() ×100%=66.67%
×100%=66.67%
(3)解:如图所示:
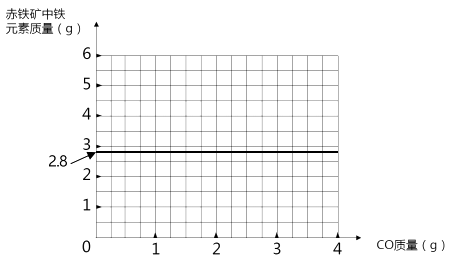
【解析】(1)、由图可知,消耗的一氧化碳为2.1g。(2)、依据化学方程式的计算,由图中计算可知反应前后玻璃管质量的变化(56.0-54.8)g=1.2g即氧化铁转化为铁失去的氧元素的质量,由此可算出参加反应的CO的质量为2.1g。(3)、4g氧化铁中铁元素的质量=4g-1.2g=2.8g,化学反应前后铁元素的质量不变。
所以答案是:2.1g、
解:由图中计算可知反应前后玻璃管质量的变化(56.0-54.8)g=1.2g即氧化铁转化为铁失去的氧元素的质量,由此可算出参加反应的CO的质量为2.1g。
设赤铁矿中氧化铁的质量为x,
3CO+ | Fe2O3 |
84 | 160 |
2.1g | x |
160:x=(3×28):21 得x=4g
赤铁矿氧化铁的质量分数为: ![]() ×100%=66.67%
×100%=66.67%
答:赤铁矿氧化铁的质量分数为66.67%。解:如图所示:


练习册系列答案
相关题目