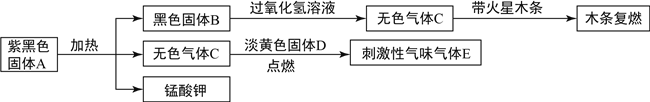
题目内容
【题目】下表为元素周期表中部分元素的相关信息,仔细观察后回答相关问题:
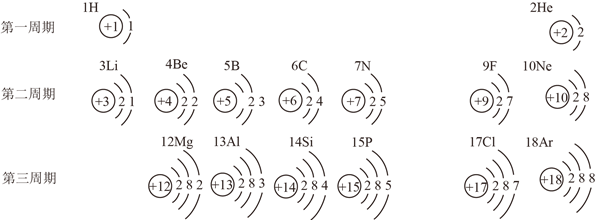
(1)8号元素的原子结构示意图为____________________,该原子在化学反应中容易__________电子。
(2)微粒 的符号为__________。
的符号为__________。
(3)11、17号元素所形成的化合物,保持其化学性质的最小微粒是__________(填选“分子、原子、离子”)。
(4)上表中所列出的6种第三周期元素中共有__________种非金属元素。同一周期的元素从左向右核外电子排布的变化规律是__________________________________________________。
(5)C和Ar属于不同种元素,其根本原因是________________________________________。
(6)写出与氖原子核外电子排布相同的一种阳离子符号______________________________。
(7)最外层电子数相同的元素化学性质可能相似,下列各组元素化学性质相似的是(______)
A.Mg和He B.F和Cl C.He和Ar
【答案】 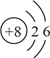 得到 S2- 离子 四种 最外层电子数由1~8(1~2)依次增多 质子数不同(核电荷数不同) Na+(或Mg2+、Al3+) BC
得到 S2- 离子 四种 最外层电子数由1~8(1~2)依次增多 质子数不同(核电荷数不同) Na+(或Mg2+、Al3+) BC
【解析】(1)根据原子的核外电子排布规律进行解答;当最外层电子数大于等于四时易得到电子,小于四时易失去电子;(2)根据核电荷数确定元素种类,根据核外电子总数确定是否带电以及带电量;(3)分子构成的物质保持其化学性质最小的微粒是分子,原子构成的物质保持其化学性质最小的微粒是原子,离子构成的物质保持其化学性质最小的微粒是离子。NaCl是由钠离子和氯离子构成;(4)根据元素名称确定是否是非金属元素;(5)根据元素的定义进行回答;(6)氖原子核外电子第一层有两个电子,第二层有8个电子。阳离子要求核电荷数大于核外电子数,满足这些条件即可;(7)画出核外电子排布即可,注意稀有气体原子最外层为满层。(1)8号元素的原子结构示意图为 ,该原子在化学反应中容易得到电子;(2)由结构示意图可知,质子数为16,是硫元素,核外电子数比质子数多2个,即得到2个电子,带2个单位的负电荷,故该微粒表示的符号为:S2-;(3)11元素是钠元素,17号元素是氯元素,故11、17号元素所形成的化合物是氯化钠,氯化钠由由钠离子和氯离子构成,所以保持氯化钠化学性质的微粒是氯离子和钠离子;(4) 表中所列出的6种第三周期元素的名称分别是:镁、铝、硅、磷、氯、氩。由名称可知,共有4种非金属元素。同一周期的元素从左向右核外电子排布的变化规律是:最外层电子数由1~8依次增多;(5)C和Ar属于不同种元素,其根本原因是质子数不同;(6) 氖原子核外电子第一层有两个电子,第二层有8个电子,与氖原子核外电子排布相同的一种阳离子符号为:Na+(或Mg2+、Al3+);(7) A、Mg原子最外层电子数为2,He原子最外层电子数也为2,虽然两种元素的原子的最外层电子数相同,但它们的化学性质却完全不同。He为稀有气体元素的原子,化学性质稳定;而Mg原子最外层电子数为2,易失最外层的2个电子形成稳定结构,化学性质不同,错误; B、F和Cl位于同一族,最外层电子数相同,化学性质相似,正确; C、He最外层电子数为2的稳定结构,属于稀有气体元素的原子,化学性质稳定; Ar质子数为18,最外层电子达8电子稳定结构,属于稀有气体元素的原子,性质稳定,化学性质相似,正确。故选BC。
,该原子在化学反应中容易得到电子;(2)由结构示意图可知,质子数为16,是硫元素,核外电子数比质子数多2个,即得到2个电子,带2个单位的负电荷,故该微粒表示的符号为:S2-;(3)11元素是钠元素,17号元素是氯元素,故11、17号元素所形成的化合物是氯化钠,氯化钠由由钠离子和氯离子构成,所以保持氯化钠化学性质的微粒是氯离子和钠离子;(4) 表中所列出的6种第三周期元素的名称分别是:镁、铝、硅、磷、氯、氩。由名称可知,共有4种非金属元素。同一周期的元素从左向右核外电子排布的变化规律是:最外层电子数由1~8依次增多;(5)C和Ar属于不同种元素,其根本原因是质子数不同;(6) 氖原子核外电子第一层有两个电子,第二层有8个电子,与氖原子核外电子排布相同的一种阳离子符号为:Na+(或Mg2+、Al3+);(7) A、Mg原子最外层电子数为2,He原子最外层电子数也为2,虽然两种元素的原子的最外层电子数相同,但它们的化学性质却完全不同。He为稀有气体元素的原子,化学性质稳定;而Mg原子最外层电子数为2,易失最外层的2个电子形成稳定结构,化学性质不同,错误; B、F和Cl位于同一族,最外层电子数相同,化学性质相似,正确; C、He最外层电子数为2的稳定结构,属于稀有气体元素的原子,化学性质稳定; Ar质子数为18,最外层电子达8电子稳定结构,属于稀有气体元素的原子,性质稳定,化学性质相似,正确。故选BC。