题目内容
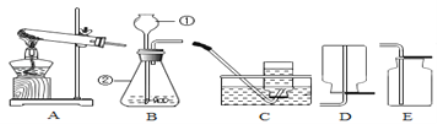
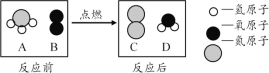
【题目】发展利用太阳能可以推进节能减排,晶体硅是制造太阳能电池板的重要原料图是工业上以石英砂(SiO2)为主要原料制取纯硅的一种方法,请回答以下问题。

(1)地壳中硅元素的含量仅次于____元素(填元素符号)。
(2)将石英砂粉碎的目的是____。
(3)写出步骤②的化学方程式:___,步骤③反应过程中若混入氧气,可能发生的后果是____。
(4)上述流程三个步骤中发生置换反应是____(填序号)。
(5)写出副产品CO的一种用途:____。
(6)根据上述流程制取5.6t纯硅,则石英砂中至少含____二氧化硅。
【答案】O 增大接触面积,使反应更充分 Si+2Cl2= SiCl4 爆炸 ①③ 燃料或冶炼金属 12t
【解析】
(1)地壳中硅元素的含量仅次于氧元素;
(2)将石英砂粉碎的目的是增大与焦炭的接触面积,使反应更充分;
(3)步骤②是硅和氯气反应生成四氯化硅,化学方程式为:Si+2Cl2= SiCl4,步骤③反应过程中若混入氧气,由于氢气是可燃性气体,高温条件下可能发生爆炸;
(4)三个步骤的反应方程式分别为:①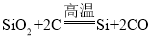 ;②Si+2Cl2= SiCl4;③
;②Si+2Cl2= SiCl4;③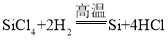 ;其中①③的反应物和生成物都是单质和化合物,属于置换反应;
;其中①③的反应物和生成物都是单质和化合物,属于置换反应;
(5)CO有可燃性、还原性,可以用作燃料或冶炼金属;
(6)纯硅中的硅元素来源于二氧化硅,设二氧化硅的质量为x,x×![]() 5.6t,x=12t。
5.6t,x=12t。

【题目】某同学为了测定石灰石中钙元素的含量(假设石灰石中除CaCO3含钙元素外,杂质不含钙元素、且不溶于水、不与酸反应),进行如下实验:称取20g石灰石样品放入烧杯中,将80g稀盐酸分4等份,分4次加入烧杯中,充分反应后称量。所得数据如下:
次 数 | 1 | 2 | 3 | 4 |
每次加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
充分反应后烧杯中物质的质量/g | 37.8 | 55.6 | 74.5 | 94.5 |
(1)充分反应后共生成CO2的质量为__________g。
(2)求样品中含CaCO3的质量_______(列化学方程计算)。
(3)该石灰石中钙元素的质量分数为____________。