题目内容
(1)实验室现有质量分数为10%的NaOH溶液100g,由于实验要求,急需一定量的20%的NaOH溶液,我们可以往10%的溶液中加入NaOH固体 g,或者蒸发水 g均可达到目的.(2)现有t℃下200g某物质的溶液,若蒸发掉20g水后,析出固体为5g,若蒸发30g水,析出固体为15g,则在t℃下该物质的溶解度为 g.
【答案】分析:(1)运用溶质质量分数的公式及公式变形分析.
(2)运用溶解度的概念分析.
解答:解:(1)10%的NaOH溶液100g中溶质氢氧化钠的质量是10g,溶剂水的质量为90g,
设加入氢氧化钠固体的质量为x,溶液会变为20%的氢氧化钠的溶液
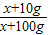 ×100%=20%
×100%=20%
x=12.5g
设蒸发水的方法要蒸发掉水的质量为y
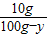 ×100%=20%
×100%=20%
y=50g.
故(1)答案:12.5;50.
(2)由t℃下200g某物质的溶液,若蒸发掉20g水后,析出固体为5g,若蒸发30g水,析出固体为15g知该温度下10g溶剂水中溶解10g该物质达到饱和状态,
所以该温度下该物质的溶解度为100g.
故答案:100g.
点评:本题考查了运用溶液中溶质质量分数的公式的计算;还考查了分析数据得出物质的溶解度,关键是抓住溶解度的概念.
(2)运用溶解度的概念分析.
解答:解:(1)10%的NaOH溶液100g中溶质氢氧化钠的质量是10g,溶剂水的质量为90g,
设加入氢氧化钠固体的质量为x,溶液会变为20%的氢氧化钠的溶液
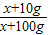 ×100%=20%
×100%=20%x=12.5g
设蒸发水的方法要蒸发掉水的质量为y
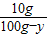 ×100%=20%
×100%=20%y=50g.
故(1)答案:12.5;50.
(2)由t℃下200g某物质的溶液,若蒸发掉20g水后,析出固体为5g,若蒸发30g水,析出固体为15g知该温度下10g溶剂水中溶解10g该物质达到饱和状态,
所以该温度下该物质的溶解度为100g.
故答案:100g.
点评:本题考查了运用溶液中溶质质量分数的公式的计算;还考查了分析数据得出物质的溶解度,关键是抓住溶解度的概念.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目