题目内容
【题目】据图回答下列问题。
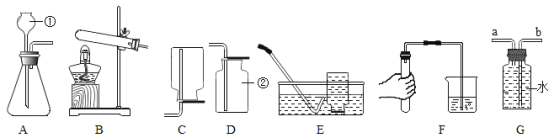
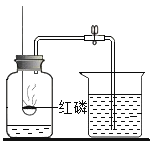
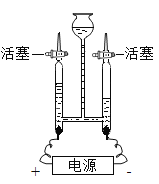
(1)写出实验仪器的名称:①______;②______。
(2)图F装置的实验目的是______;
(3)用图A所示装置制取氧气反应的文字表达式为______;
(4)若用B装置制取氧气,应选用的药品是______;
(5)用排空气法收集一瓶氧气,验满的方法是______;
(6)用图G所示装置收集氧气氧气应从______(填“a”或“b”)端通入。
【答案】长颈漏斗 集气瓶 检查装置的气密性,防止装置漏气 过氧化氢![]() 水+氧气 氯酸钾和二氧化锰 把带火星的木条放在集气瓶口,若木条复燃则集满 a
水+氧气 氯酸钾和二氧化锰 把带火星的木条放在集气瓶口,若木条复燃则集满 a
【解析】
过氧化氢在二氧化锰的催化作用下生成氧气和水,氯酸钾和二氧化锰加热生成氯化钾和氧气。
(1)①是长颈漏斗;②是集气瓶。
(2)图F装置的实验目的是:检查装置的气密性,防止装置漏气。
(3)A装置属于固、液常温型,适合用过氧化氢制取氧气,过氧化氢在二氧化锰的催化作用下生成氧气和水,反应的文字表达式为:过氧化氢![]() 水+氧气。
水+氧气。
(4)装置B属于固、固加热型,试管口没有棉花,适合用氯酸钾和二氧化锰混合制取氧气。
(5)氧气的密度比空气大,具有助燃性,所以用排空气法收集氧气,验满的方法是:把带火星的木条放在集气瓶口,若木条复燃则集满。
(6)氧气不易溶于水,密度比水小,所以用图G所示装置收集氧气氧气应从a端通入。

【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验.
①为探究![]() 、CuO、
、CuO、![]() 对氯酸钾分解速度的影响,甲设计以下对比实验:
对氯酸钾分解速度的影响,甲设计以下对比实验:
Ⅰ![]() 将2.45g
将2.45g ![]() 加热至质量不再改变
加热至质量不再改变
Ⅱ![]() 将2.45g
将2.45g![]() 与1.0g
与1.0g ![]() 均匀混合加热至质量不再改变
均匀混合加热至质量不再改变
Ⅲ![]() 将xg
将xg ![]() 与
与![]() CuO均匀混合加热至质量不再改变
CuO均匀混合加热至质量不再改变
Ⅳ![]() 将2.45g
将2.45g ![]() 与
与![]() 均匀混合加热至质量不再改变
均匀混合加热至质量不再改变
在相同温度下加热至完全反应,比较四组实验产生![]() 的多少及快慢,记录如下:
的多少及快慢,记录如下:
反应时间 | 收到 | |
Ⅰ | 6000s |
|
Ⅱ | 60s |
|
Ⅲ | 180s |
|
Ⅳ | 70s |
|
Ⅱ中反应的符号表达式是 ______ ;Ⅲ中x的值应为 ______ .
②从Ⅱ反应后的产物中回收![]() 已知两种固体剩余物中只有
已知两种固体剩余物中只有![]() 不溶于水
不溶于水![]() ,其步骤是:溶解、 ______ 、洗涤干燥.
,其步骤是:溶解、 ______ 、洗涤干燥.
③Ⅳ中除了氯酸钾分解速度比较快其产生氧气的量也比较多,请你回答下列问题:
![]() 写出产生氧气多出的原因是: ______ .
写出产生氧气多出的原因是: ______ .
![]() 分解速度比较快的原因是: ______
分解速度比较快的原因是: ______ ![]() 填序号
填序号![]()
A ![]() 是该反应的催化剂 B
是该反应的催化剂 B ![]() 分解生成的
分解生成的![]() 是该反应的催化剂
是该反应的催化剂
④![]() 中,Mn元素的化合价是 ______ .
中,Mn元素的化合价是 ______ .
【题目】某学习小组的同学对过氧化氢分解进行探究。
I.(探究一)影响过氧化氢分解快慢的因素
分别取5mL过氧化氢溶液进行实验,测定产生4mL氧气所需时间,实验结果记录
实验序号 | 过氧化氢溶液的浓度% | 温度℃ | 二氧化锰粉末用量/g | 反应时间 |
① | 30 | 35 | 0 |
|
② | 30 | 55 | 0 |
|
③ | 5 | 20 | 0.1 | 3s |
④ | 15 | 200 | 0.1 | 1s |
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,则![]() ______
______![]() (填“>”“=”“<”)
(填“>”“=”“<”)
(2)能说明过氧化氢分解快慢与浓度有关的实验是______(填实验序号,合理的结论是____________。
(交流探讨)二氧化锰属于金属氧化物,其它金属氧化物能否起到类似二氧化锰的催化作用?
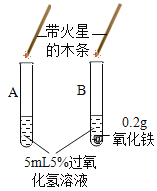
Ⅱ、(探究二)探究氧化铁是否对过氧化氢分解起催化作用
操作步骤 | 实验情况记录 | 结论 | |
① |
| A试管上方带火星的木条未复燃 B中出现气泡快,带火星的木条复燃 | 氧化铁______(填“不影响”、“减慢”或“加快”)过氧化氢分解 |
② | 将B试管中的混合物过滤,把滤渣烘干、______。 | 固体质量0.2g | 氧化铁质量未变 |
③ |
| C试管上方带火星的木条______ | 氧化铁可作过氧化氢分解的催化剂 |
(得出结论)过氧化氢分解快慢受催化剂、______、______等因素影响。