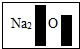题目内容
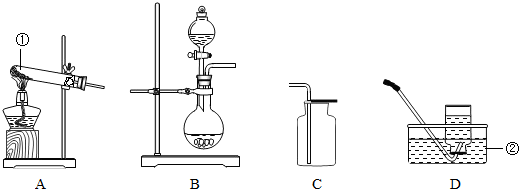
化学兴趣小组在实验室用过氧化氢溶液和催化剂二氧化锰粉末采用下图来制取氧气,但对老师提供的一瓶标签模糊的“■■水”产生了争议,小明认为是蒸馏水,小华认为是俗称“双氧水”的过氧化氢溶液.(1)请你帮助他们检验该瓶试剂.
| 操作步骤 | 现象 | 结论 |
(3)为了得到干燥的氧气他们在老师的指导下用浓硫酸除去氧气中混有的水蒸气,设计了如下图所示的装置图,请你在方框中添上带橡皮塞的玻璃管.

(4)小华同学想继续“探究红砖粉作为过氧化氢溶液分解反应中的催化剂”这一命题,她设计并完成了下表所示的探究实验:
| 实验操作 | 实验现象 | 实验结论或总结 | ||
| 各步骤结论 | 总结 | |||
| 实验一 | 在一支试管中倒入一定量的过氧化氢溶液,伸入带火星的木条. | 有极少量的气泡,木条不复燃 | 过氧化氢在常温下能产生少量氧气 | 红砖粉是过氧化氢分解的催化剂 |
| 实验二 | 加入少量红砖粉,伸入带火星木条. | 木条复燃 | 过氧化氢溶液和红砖粉混合能____产生氧气. | |
②小明同学认为仅由上述实验还不能完全得出表内“总结”,他补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明.
第一方面的实验操作中包含了两次称量,其目的是:______;第二方面的实验是需要证明______.
③写出双氧水在红砖粉的作用下分解的符号表达式______ 2H2O+O2↑
【答案】分析:(1)根据过氧化氢的性质设计实验进行判断,常温下双氧水在二氧化锰催化下可分解放出氧气,而蒸馏水常温下不能分解;
(2)分液漏斗能够控制滴加液体的速度和质量,因此发生装置使用分液漏斗能够控制反应速率,而得到平稳气流;
(3)用浓硫酸除去氧气中混有的水蒸气,需要使混有水蒸气的混合气体通过浓硫酸,因此所设计的装置应满足这一要求;
(4)在验证红砖粉的催化作用时,可设计对比实验,利用对比实验说明红砖粉能加快反应的速度,且反应前后二氧化锰的质量的化学性质保持不变.
解答:解:(1)可取适量无色液体加入少量二氧化锰,若有气体产生,则可说明无色液体为双氧水即过氧化氢溶液;
(2)利用分液漏斗能起到控制滴加过氧化氢溶液的速度和质量,因此达到控制反应放出氧气速度的目的,而实现得到平稳气流的作用;
(3)为满足使混有水蒸气的混合气体通过浓硫酸的干燥要求,进气导管需伸入浓硫酸中,而出气导管只需要露出橡胶塞少许;
(4)①红砖粉只是改变化学反应的速率,所以在设计实验时设计了二个对比实验:一个实验在试管中只放双氧水,双氧水也能分解产生氧气,但产生氧气的速度太慢.第二个实验,在试管中既放双氧水也放红砖粉,能很快的放出氧气;
②为了说明红砖粉在此实验中反应前后的质量保持不变.做了两次称量,目的是比较红砖粉反应前后质量是否变化.还需要验证红砖粉在反应后的化学性质是否改变.
③双氧水在红砖粉的催化作用下分解的化学方程式为2H2O2 2H2O+O2↑;
2H2O+O2↑;
故答案为:
(1)
(2)能;
(3)

(4)①对比(或对照等);②比较红砖粉在过氧化氢分解前后的质量;红砖粉的化学性质不变;③2H2O2 2H2O+O2↑.
2H2O+O2↑.
点评:在确定一种物质是催化剂时,不但要确定它能否改变化学反应的速率,还要确定它反应前后的质量和化学性质是否改变.只有这两条都不变,才是催化剂.
(2)分液漏斗能够控制滴加液体的速度和质量,因此发生装置使用分液漏斗能够控制反应速率,而得到平稳气流;
(3)用浓硫酸除去氧气中混有的水蒸气,需要使混有水蒸气的混合气体通过浓硫酸,因此所设计的装置应满足这一要求;
(4)在验证红砖粉的催化作用时,可设计对比实验,利用对比实验说明红砖粉能加快反应的速度,且反应前后二氧化锰的质量的化学性质保持不变.
解答:解:(1)可取适量无色液体加入少量二氧化锰,若有气体产生,则可说明无色液体为双氧水即过氧化氢溶液;
(2)利用分液漏斗能起到控制滴加过氧化氢溶液的速度和质量,因此达到控制反应放出氧气速度的目的,而实现得到平稳气流的作用;
(3)为满足使混有水蒸气的混合气体通过浓硫酸的干燥要求,进气导管需伸入浓硫酸中,而出气导管只需要露出橡胶塞少许;
(4)①红砖粉只是改变化学反应的速率,所以在设计实验时设计了二个对比实验:一个实验在试管中只放双氧水,双氧水也能分解产生氧气,但产生氧气的速度太慢.第二个实验,在试管中既放双氧水也放红砖粉,能很快的放出氧气;
②为了说明红砖粉在此实验中反应前后的质量保持不变.做了两次称量,目的是比较红砖粉反应前后质量是否变化.还需要验证红砖粉在反应后的化学性质是否改变.
③双氧水在红砖粉的催化作用下分解的化学方程式为2H2O2
 2H2O+O2↑;
2H2O+O2↑;故答案为:
(1)
| 作步骤 | 现象 | 结论 |
| 取少量的液体于试管中,向其中加入少量二氧化锰 | 若反应产生气泡 若无现象 | 该液体为双氧水 该液体为蒸馏水 |
(3)

(4)①对比(或对照等);②比较红砖粉在过氧化氢分解前后的质量;红砖粉的化学性质不变;③2H2O2
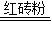 2H2O+O2↑.
2H2O+O2↑.点评:在确定一种物质是催化剂时,不但要确定它能否改变化学反应的速率,还要确定它反应前后的质量和化学性质是否改变.只有这两条都不变,才是催化剂.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
 (2013?信阳一模)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示)的溶液,他们对此产生了兴趣.
(2013?信阳一模)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示)的溶液,他们对此产生了兴趣. (2013?本溪)某化学兴趣小组在实验室做了如图所示的A、B两个实验.
(2013?本溪)某化学兴趣小组在实验室做了如图所示的A、B两个实验.