题目内容
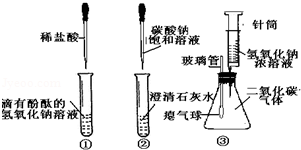
同学们在学习酸和碱的化学性质时,进行了如图所示的实验
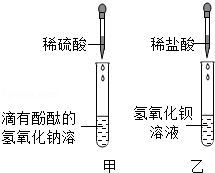
(1)甲实验中能证明两种物质发生反应的明显现象是
(2)实验结束后,同学们将甲、乙两个实验所得的无色废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色
【提出问题】废液中含有哪些物质?
【交流讨论】①一定含有的物质:硫酸钡、指示剂、水、碱类物质和 (写化学式或名称)
②对碱类物质是什么?同学们有如下猜想
猜想一:只有氢氧化钠
猜想二:只有氢氧化钡
猜想三:是氢氧化钠和氢氧化钡
你认为猜想 是错误的
【实验设计】若要证明剩余的两种猜想,可选用的试剂是

(1)甲实验中能证明两种物质发生反应的明显现象是
(2)实验结束后,同学们将甲、乙两个实验所得的无色废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色
【提出问题】废液中含有哪些物质?
【交流讨论】①一定含有的物质:硫酸钡、指示剂、水、碱类物质和 (写化学式或名称)
②对碱类物质是什么?同学们有如下猜想
猜想一:只有氢氧化钠
猜想二:只有氢氧化钡
猜想三:是氢氧化钠和氢氧化钡
你认为猜想 是错误的
【实验设计】若要证明剩余的两种猜想,可选用的试剂是
(1)红色溶液变成无色;(2)【交流讨论】①氯化钠或NaCl;②猜想二;【实验设计】硫酸或硫酸钠等可溶性硫酸盐
试题分析:(1)酚酞溶液遇碱变红,但是遇到中性和酸性溶液都不变色,硫酸和氢氧化钠反应要生成硫酸钠和水,它们恰好完全反应后的溶液为中性,所以红色要消失;(2)【交流讨论】①甲实验中硫酸和氢氧化钠反应生成硫酸钠和水,而乙实验中盐酸和氢氧化钡反应生成了氯化钡和水,它们混合后,硫酸钠要和氯化钡反应生成硫酸钡沉淀和氯化钠,所以在溶液中还存在着氯化钠;②根据①的解答可以知道,溶液中存在着碱性物质,由于甲实验中氢氧化钠已被完全消耗,如果存在碱性物质,必然是乙实验中过量的氢氧化钡,而氢氧化钡和硫酸钠可以反应生成硫酸钡沉淀和氢氧化钠,所以可以判断在碱性物质一定含有氢氧化钠,至于是不是含有氢氧化钡则应该看硫酸钠的量,也就是说氢氧化钡可能存在也可能不存在,但绝对不能是单纯的氢氧化钡;【实验设计】根据剩余的两种猜想可以知道它们的差别在于是不是含有氢氧化钡,所以只要验证是否含有氢氧化钡即可完成判断,根据氢氧化钡的性质可以用硫酸或硫酸钠等可溶性硫酸盐来进行验证,如果产生了表示沉淀,则证明猜想三正确,如果没有白色沉淀产生,则说明猜想一正确

练习册系列答案
相关题目