题目内容
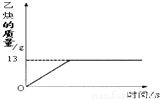
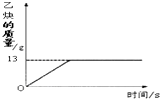 (1)乙炔(C2H2)是一种重要化工原料,实验室常用碳化钙(CaC2)与水反应制取.某化学兴趣小组取一定质量的碳化钙与90g水反应,产生气体的质量与反应时间的关系如图所示,请回答下列问题:
(1)乙炔(C2H2)是一种重要化工原料,实验室常用碳化钙(CaC2)与水反应制取.某化学兴趣小组取一定质量的碳化钙与90g水反应,产生气体的质量与反应时间的关系如图所示,请回答下列问题:①碳化钙(CaC2)与水反应的化学方程式为:CaC2+2H2O=X+C2H2↑.其中X是一种碱,
则X的化学式为
Ca(OH)2
Ca(OH)2
;②取用碳化钙的质量为
32g
32g
.(2)有一种有机物23克,在空气中完全燃烧后,共生成44克二氧化碳和27克水,则该有机物中碳氢元素的质量比为
2:1
2:1
;该有机物是有碳、氢
碳、氢
元素氧元素
氧元素
组成.(3)A、B两元素的原子量之比7:2,由它们组成的一种化合物中,A、B两种元素质量比为21:8.求此化合物的化学式
A3B4或B4A3
A3B4或B4A3
.分析:(1)根据质量守恒定律:反应前后原子的种类和数目不变判断X的化学式;图象中曲线折点表示恰好完全反应,此时生成乙炔的质量为13g;根据反应的化学方程式,由生成乙炔的质量计算取用碳化钙的质量;
(2)根据反应前后元素的质量和种类不变,可知生成的44g二氧化碳中所含碳元素质量和27g水中所含氢元素的质量均来自23g有机物,通过有机物质量与碳、氢元素的质量和的对比,可确定有机物中是否含氧元素及碳、氢元素的质量比;
(3)可通过假设原子个数的方法,利用所给的数据计算出两元素的原子个数比,最后完成化学式的推断.
(2)根据反应前后元素的质量和种类不变,可知生成的44g二氧化碳中所含碳元素质量和27g水中所含氢元素的质量均来自23g有机物,通过有机物质量与碳、氢元素的质量和的对比,可确定有机物中是否含氧元素及碳、氢元素的质量比;
(3)可通过假设原子个数的方法,利用所给的数据计算出两元素的原子个数比,最后完成化学式的推断.
解答:解:(1)①反应前钙原子的个数是1个,碳原子的个数是2个,氢原子的个数是4个,氧原子的个数是2个;反应后碳原子的个数是2个,氢原子的个数是2个,故X分子由1个钙原子、2个氧原子和2个氢原子构成,化学式是Ca(OH)2;
②由图象可知:生成乙炔的质量是13g,设碳化钙的质量为x
CaC2+2H2O=Ca(OH)2+C2H2↑
64 26
x 13g
=
x=32g
(2)由质量守恒定律可知,该化合物中一定含有碳氢两种元素,且其质量等于生成物中碳氢元素的质量;据44g二氧化碳中所含碳元素质量=44g×
×100%=12g,27g水中所含氢元素的质量=27g×
×100%=6g,由此可知:有机物中碳、氢元素的质量比是12g:6g=2:1,该化合物中碳、氢元素的质量和=12g+6g=18g,小于有机物的质量32g,因此有机物中含氧元素,其中氧元素的质量=32g-18g=14g;
(3)假设化合物的化学式为AaBb,设元素A的相对原子质量为7X,则元素B的相对原子质量为2X,化合物AaBb中A、B两元素的质量比=(7X×a):(2X×b)=7a:2b,根据题意:化合物中X、Y两元素的质量比为21:8,则7a:2b=21:8
解得a:b=3:4
则这种化合物的化学式为A3B4或B4A3;
故答案为:(1)①Ca(OH)2;②32g;
(2)2:1;碳、氢、氧元素;
(3)A3B4或B4A3.
②由图象可知:生成乙炔的质量是13g,设碳化钙的质量为x
CaC2+2H2O=Ca(OH)2+C2H2↑
64 26
x 13g
| 64 |
| x |
| 26 |
| 13g |
x=32g
(2)由质量守恒定律可知,该化合物中一定含有碳氢两种元素,且其质量等于生成物中碳氢元素的质量;据44g二氧化碳中所含碳元素质量=44g×
| 12 |
| 44 |
| 2 |
| 18 |
(3)假设化合物的化学式为AaBb,设元素A的相对原子质量为7X,则元素B的相对原子质量为2X,化合物AaBb中A、B两元素的质量比=(7X×a):(2X×b)=7a:2b,根据题意:化合物中X、Y两元素的质量比为21:8,则7a:2b=21:8
解得a:b=3:4
则这种化合物的化学式为A3B4或B4A3;
故答案为:(1)①Ca(OH)2;②32g;
(2)2:1;碳、氢、氧元素;
(3)A3B4或B4A3.
点评:本题既考查了方程式的相关计算,又考查了质量守恒定律的应用,化学式的确定,考查知识比较全面,要根据相关知识仔细分析解答.

练习册系列答案
相关题目
 (1)乙炔(C2H2)是一种重要化工原料,实验室常用碳化钙(CaC2)与水反应制取.某化学兴趣小组取一定质量的碳化钙与90g水反应,产生气体的质量与反应时间的关系如图所示,请回答下列问题:
(1)乙炔(C2H2)是一种重要化工原料,实验室常用碳化钙(CaC2)与水反应制取.某化学兴趣小组取一定质量的碳化钙与90g水反应,产生气体的质量与反应时间的关系如图所示,请回答下列问题: