题目内容
【题目】甲乙丙三位同学分别取铁粉和铜粉的均匀混合物与某稀硫酸反应,所得数据如下:
甲 | 乙 | 丙 | |
取用金属混合物的质量 | 10 | 10 | 20 |
取用稀硫酸的质量/g | 100 | 120 | 100 |
反应后过滤得到干燥固体的质量/g | 2 | 2 | 12 |
计算:
(1)金属混合物中铁的质量分数_________.
(2)甲制得硫酸亚铁的质量_________.
(3)该稀硫酸中溶质的质量分数_________.
【答案】80% 21.7g 14%
【解析】
铁能与稀硫酸反应生成氢气,铜不与稀硫酸反应生成氢气,取10g混合物,与100g硫酸和120g硫酸反应都剩余2g固体,则可以判断10g混合物中含有铜的质量为2g,含铁的质量为8g,取20g混合物,与100g硫酸反应剩余12g固体,则说明与8g铁反应需要硫酸的质量为100g。
(1)取10g混合物,与100g硫酸和120g硫酸反应都剩余2g固体,则可以判断10g混合物中含有铜的质量为2g,含铁的质量为8g,故金属混合物中铁的质量分数为![]()
(2)取20g混合物,与100g硫酸反应剩余12g固体,则说明与8g铁反应需要硫酸的质量为100g。
设甲制得硫酸亚铁的质量为x
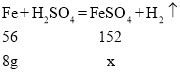
![]()
![]()
故甲制得硫酸亚铁的质量为21.7g。
(3)设该稀硫酸中溶质的质量为y
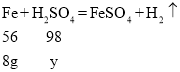
![]()
![]()
故稀硫酸中溶质的质量分数为![]()

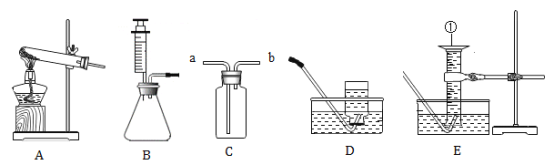
【题目】某同学在家中发现,炒完菜的铁锅表面容易生锈。于是设计并进行实验,探秘铁生锈的条件。
(查阅资料)干燥剂是指能除去潮湿物质中水份的物质。如硫酸钙和氯化钙等。
(猜想与假设)常温下,铁生锈可能与O2、食盐、水蒸气有关。
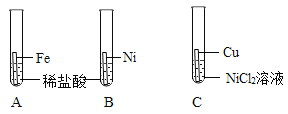
(进行实验)利用下图装置(铁丝长度及粗细相同,反应装置相同,忽略烧杯中水的蒸发)
控制与铁丝接触的物质,分别进行下列5个实验:

实验结果显示:B、D实验中铁生了锈,而A、C、E实验中没有明显的现象。实验时,每隔一段时间测量导管内水面上升的高度,结果如下表所示(表中所列数据为导管中水面上升的高度/cm ):
时间、小时 | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
A | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
B | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
C | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
D | 0 | 0.4 | 1.2 | 3.4 | 7.6 | 9.5 | 9.8 |
E | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
(解释与结论)
(1) 实验中通过对比实验B和C,得出的结论是______。
(2) 得出“铁生锈一定与H2O有关”的结论,依据的两个实验是______ (填编号)。
(3) 根据本实验,你认为导致铁生锈的物质一定有 ______。
(4) 导致B、D实验装置中导管内水面上升的原因是______,通过以上实验,猜测食盐的作用是______。
(反思与评价)
(5) 在猜想与假设时,同学们认为铁丝生锈与N2无关,其理由是______ 。
(6) 结合上述实验,谈谈你对家中铁锅使用的建议______:。