��Ŀ����
����Ŀ��
��1����������ˮ�йصļ����������������ѧ֪ʶ��д������
����Ȼ���е�ˮ�������ѡ��������������
�������������ƣ����������ԣ�������ˮ�ľ�����
�۵��H2Oʱ����ֱ����Դ����ѡ������������������ĵ缫�����õ�H2 ��
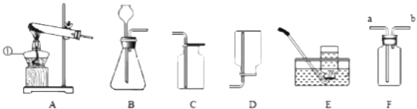
��2���ס��ҡ������ֹ������ʵ��ܽ��������ͼ��ʾ�����ͼ�ش��������⣺
����ʱ�������������ʵ��ܽ����ȣ�
��t3��ʱ�����ס��ҡ����ı�����Һ�ֱ��µ�t2����ѡ��ס������ҡ���������Ϊ��������Һ��
��t1��ʱ���ס��ҡ������ֱ�����Һ�����ʵ����������ɴ�С��˳��Ϊ ��
���𰸡�
��1����������̿����
��2��t2�����������ң���
����������1������Ȼ���е�ˮ����ǻ����ڻ���̿���������ԣ�������ˮ�ľ������۵��H2Oʱ����ֱ����Դ�ĸ��������ĵ缫�����õ�H2 �� ��2����t2��ʱ�������������ʵ��ܽ����ȣ��ڽ�t3��ʱ�ס��ҡ����������ʵı�����Һ�ֱ��µ�t2��ʱ����Ϊ���ҵ��ܽ�������¶ȵĽ��Ͷ���С��������Һ��Ϊ������Һ�������ʵ��ܽ�������¶ȵĽ��Ͷ��������Ա����ʱ�ɲ�������Һ���۱���ʱ���������ļ���ʽ ![]() ��100%�����ܽ�ȴ������ʵ�����������t1��ʱ���ס��ҡ����������ʵ��ܽ�ȴ�СΪ�������ң��ף�������Һ�����ʵ����������ɴ�С��˳��Ϊ�����ң��ף�
��100%�����ܽ�ȴ������ʵ�����������t1��ʱ���ס��ҡ����������ʵ��ܽ�ȴ�СΪ�������ң��ף�������Һ�����ʵ����������ɴ�С��˳��Ϊ�����ң��ף�
�𰸣���1���ٻ����ڻ���̿���۸�����2����t2�� �ڱ��� �۱����ң��ף�
�����㾫�������ڱ��⿼�����ȡ������̼�IJ��������ע���͵��ˮʵ�飬��Ҫ�˽�1��ԭ������ʯ��ʯ��ϡ���ᷴӦ�� CaCO3+2HCl==CaCl2+H2O+CO2��2) ѡ�ú���������ͬ�ķ���װ��3�������ռ������������ſ�����4����֤���������Ƶõ�����ͨ������ʯ��ˮ�����ܻ��ǣ����Ƕ�����̼�������������õ�ȼ��ľ�������ڼ���ƿ�ڣ�ľ��Ϩ��֤���Ѽ���������̼���壻���ˮ��ʵ�飺A.װ�èD�D�Dˮ�����B.��Դ����---ֱ����C.����������������Ƶ�Ŀ��----��ǿˮ�ĵ�����D.��ѧ��Ӧ��2H2O=== 2H2��+ O2�����ܵó���ȷ�𰸣�

 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�����Ŀ�������NaCl��KNO3�ڲ�ͬ�¶�ʱ���ܽ�ȣ���仯������ͼ��ʾ�����������������ǣ� ��
�¶�/�� | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
�ܽ��/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
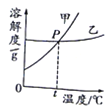
A.100gˮ��������ܽ�KNO331.6g
B.��ʾNaCl���ܽ�������Ǽ�
C.�¶�t�ķ�Χ������20�橁30��֮��
D.��������Һ��Ϊ������Һ�����ʵ�������������