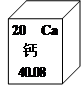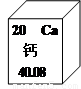题目内容
 钙元素在人类的生命和生活中具有重要意义.
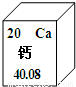
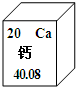
钙元素在人类的生命和生活中具有重要意义.(1)在元素周期表中,钙元素的信息如图所示.则钙元素的相对原子质量为
40.80
40.80
.(2)氧化钙可做某些食品的干燥剂,用化学方程式表示其原理:
CaO+H2O=Ca(OH)2
CaO+H2O=Ca(OH)2
.(3)氢氧化钙俗称熟石灰,常用于制备补碘剂Ca(IO3)2,其中碘元素的化合价为:
+5
+5
价.分析:(1)根据元素周期表提供的信息可知元素的相对原子质量;
(2)根据氧化钙与水反应生成氢氧化钙分析;
(3)根据化合物正负化合价的代数和为零,可以判断碘元素的化合价.
(2)根据氧化钙与水反应生成氢氧化钙分析;
(3)根据化合物正负化合价的代数和为零,可以判断碘元素的化合价.
解答:解:(1)根据元素周期表提供的信息,钙元素的相对原子质量是40.80;
(2)氧化钙与水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2;
(3)根据化合物正负化合价的代数和为零,可以设碘元素的化合价为x,则:(+2)+[x+(-2)×3]×2=0,解得:x=+5;
故答案为:(1)40.80;
(2)CaO+H2O=Ca(OH)2;
(3)+5.
(2)氧化钙与水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2;
(3)根据化合物正负化合价的代数和为零,可以设碘元素的化合价为x,则:(+2)+[x+(-2)×3]×2=0,解得:x=+5;
故答案为:(1)40.80;
(2)CaO+H2O=Ca(OH)2;
(3)+5.
点评:本题考查学生对元素周期表提供的信息及结构示意图含义的理解与应用的能力、化学方程式的书写以及化合物中元素化合价的计算能力,难度不大.

练习册系列答案
相关题目