题目内容
【题目】小明设计了测定纯碱(Na2CO3)样品(假设只含NaCl杂质)中Na2CO3质量分数的实验方案,按下图进行实验。
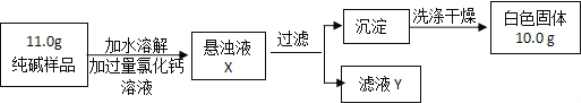
(1)滤液Y中含有的溶质有_________(填写化学式)。
(2)证明CaCl2已过量的方法是_________(填写字母序号),然后观察现象判断。
A.静置悬浊液X,向上层清液中继续滴加少量氯化钙溶液
B.取少量滤液Y于试管中,滴加氯化钙溶液
(3)若沉淀没有洗涤操作会造成碳酸钠质量分数_____(填“偏大”或“偏小”或“无影响”)。
(4)通过以上提供的数据计算出样品中碳酸钠的质量分数为多少。_____(写出计算过程,结果保留至0.1%)
【答案】 NaCl、CaCl2 A 偏大 96.4%
【解析】(1)碳酸钠与氯化钙反应生成碳酸钙和氯化钠,则过滤后滤液Y中含有的溶质为反应生成的NaCl和过量的CaCl2;
(2)判断加入氯化钙溶液是否过量的合适方法是:静置混合物X,向上层清液中再滴少许氯化钙溶液,如有沉淀生成,说明氯化钙溶液不足;故选A;
(3)因为在沉淀表面的可溶性杂质氯化钠和氯化钙,所以沉淀洗涤的目的是:除去沉淀表面的可溶性杂质;若不洗涤,杂质氯化钠和氯化钙的质量当作沉淀物的质量,即样品中所含的碳酸根偏大,导致碳酸钠的质量分数偏大;
(4)设样品中碳酸钠的质量是X
CaCl2+Na2CO3═CaCO3↓+2NaCl
106 100
X 10g![]() =
=![]() ,解得:X=10.6g,所以样品中碳酸钠的质量分数是
,解得:X=10.6g,所以样品中碳酸钠的质量分数是![]() ×100%=96.4%。
×100%=96.4%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目