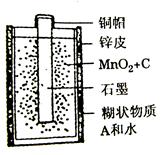
题目内容
用实验验证Zn、Cu、Ag三种金属的活动性顺序,请写出两种可行方案所需的物质。
Zn、CuSO4、Ag(1分)Cu、ZnSO4、AgNO3等(1分)
解析试题分析:验证三种金属的活动性顺序时,最简单的方案为中间金属单质,两边的盐溶液;或中间的盐溶液两边的金属单质,Zn、CuSO4、Ag; Cu、ZnSO4、AgNO3等.
考点:实验方案的设计

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在实验课中,各小组作了如下实验:
| 实验编号 | 1 | 2 | 3 | 4 |
| 实验操作 | 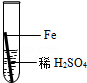 | 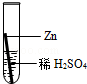 | 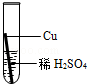 | 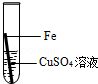 |
实验后,同学们按老师要求将废液都倒在指定的大烧杯中,小科猜想该烧杯中的废液可能有硫酸铜、硫酸锌、硫酸亚铁…,应该可以从中提炼出铁和铜.经思考后,他设计了如图所示的实验,并设法使滤液甲和乙所含的溶质相同.
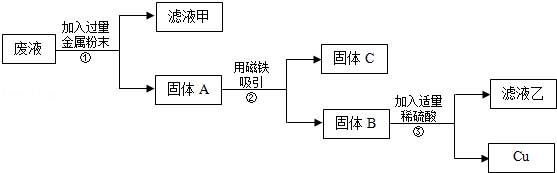
则固体C是 ,操作③的名称是 ,实验中所加的过量金属粉末是 .
(7分)人类的生产、生活离不开金属。
(1)地壳中含量最高的金属元素是 。
(2)用铜制电线主要是利用铜具有良好的延展性和 性。
(3)将生锈的铁片放入足量稀硫酸中,发生置换反应的化学方程式为 。
(4)在硫酸铜和硫酸亚铁的混合溶液中加入一定量的锌粉,充分反应后过滤,向滤渣中滴加稀硫酸,无气泡产生。则滤渣中的金属是 ,滤液中溶质的组成是 (写出所有可能)。
(5)将质量相等的锌粉和铁粉,分别放入两个烧杯中,再分别倒入质量相等、溶质的质
量分数相同的稀盐酸,充分反应,生成氢气的质量(m)随反应时间(t)变化的曲
线如图所示。下列说法正确的是 (填字母序号)。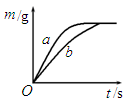
| A.消耗两种金属的质量相等 |
| B.两烧杯中金属都没有剩余 |
| C.两烧杯中稀盐酸都没有剩余 |
| D.曲线a表示锌和稀盐酸的反应 |
同学们在帮助老师整理实验室时,从1、2号橱窗中发现了两瓶失去标签的黑色粉末药品,并确定了这两瓶黑色粉末是木炭粉、铁粉、氧化铜、高锰酸钾中的两种。他们继续进行了分析、试验和反思:
【查阅资料】 CuO、Fe2O3等金属氧化物与酸反应,生成盐和水
(1)分析:小燕同学认为一定不是高锰酸钾,原因是__________________________________;
(2)实验一:
| 实验操作 | | |
| ①取一种黑色粉末少许,加入到稀硫酸中 | 黑色粉末溶解,溶液颜色变_________ | 此粉末是氧化铜 |
| ②取另一种黑色粉末少许,加入到稀硫酸中 | 黑色粉末不溶解,没看到气体产生 | 此粉末一定不是铁粉 |
(4)实验二:他们又进行了如下实验:将两种黑色粉末混合加热(实验装置如下图),发现黑色粉末逐渐变_______,澄清石灰水变____________。写出两种黑色粉末发生反应的化学方程式__________________。
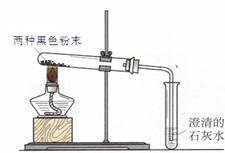
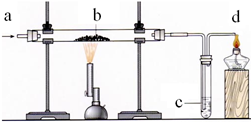
 2Fe+3C02,该反应中体现了C0具有 性;
2Fe+3C02,该反应中体现了C0具有 性;