题目内容
现有A、B、C、D四种元素,A元素原子核内没有中子,元素B形成的离子B2-与氖原子具有相同的电子层结构,C元素是地壳中含量最多的金属元素,D元素的原子核外有三个电子层,最外层有2个电子,则:A元素的名称为______,D元素的离子符号是______,A、B、C三种元素组成的化合物的化学式______.
A元素原子核内没有中子,故A为氢元素;元素B形成的离子B2-与氖原子具有相同的电子层结构,则B得到两个电子后有10个电子,B原子核外有8个电子,故B为氧元素;C元素是地壳中含量最多的金属元素,故C为铝元素;D元素的原子核外有三个电子层,最外层有2个电子,则D元素原子的质子数为12,为镁元素;
根据上述分析可知A元素为氢元素,D元素为镁元素,其离子符号为Mg2+,A、B、C三种元素组成的化合物是氢氧化铝,其化学式 Al(OH)3.
故答案为:氢; Mg2+,Al(OH)3.
根据上述分析可知A元素为氢元素,D元素为镁元素,其离子符号为Mg2+,A、B、C三种元素组成的化合物是氢氧化铝,其化学式 Al(OH)3.
故答案为:氢; Mg2+,Al(OH)3.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
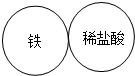 (2013?松北区二模)现有A、B、C、D四种物质分别是稀盐酸、氢氧化钠溶液、铁粉、硝酸银溶液,用四个圆形表示A(铁粉)、B(稀盐酸)、C(硝酸银溶液)、D(氢氧化钠溶液)四种物质,用相邻的圆形相切表示两种物质可以发生反应,请回答下列问题:
(2013?松北区二模)现有A、B、C、D四种物质分别是稀盐酸、氢氧化钠溶液、铁粉、硝酸银溶液,用四个圆形表示A(铁粉)、B(稀盐酸)、C(硝酸银溶液)、D(氢氧化钠溶液)四种物质,用相邻的圆形相切表示两种物质可以发生反应,请回答下列问题: