题目内容
(3分)过氧化钠(Na2O2)是一种供氧剂,与水反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑。将一定量的Na2O2加入到87.6g水中,完全反应后所得溶液的质量比反应物的总质量减少了3.2g(水的挥发忽略不计)。请计算:
(1)生成氧气的质量为_____g。
(2)反应后所得溶液中溶质的质量。
(3)将所得溶液稀释成溶质的质量分数为10%的溶液,需加水的质量。
(1)3.2;(2)16g;(3)60g
【解析】
试题分析:(1)根据质量守恒定律知,反应物减少的质量为生成的氧气的质量,故生成氧气的质量为3.2g
(2)【解析】
设参加反应的过氧化钠的质量为x,生成氢氧化钠的质量为y。
2Na2O2+2H2O===4NaOH+O2↑
156 160 32
x y 3.2g
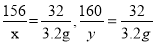
解得x=15.6g,y=16g
反应后所得溶液中溶质的质量为16g
(3)16g/10% - (15.6+87.6-3.2) g=60 g
答:反应后所得溶液中溶质的质量为16g,将所得溶液稀释成溶质的质量分数为10%的溶液,需加水的质量为60g
考点:质量守恒定律、化学方程式的计算、有关溶液的计算

练习册系列答案
相关题目
下表列出了除去物质中所含少量杂质的方法,其中错误的是
选项 | 物质 | 所含杂质 | 除去杂质的方法 |
A | H2 | HCl | 先通过NaOH溶液,再通过浓硫酸 |
B | CaO | CaCO3 | 加入稀盐酸至不再产生气泡 |
C | NaCl溶液 | Na2CO3 | 加入稀盐酸至不再产生气泡 |
D | FeCl2溶液 | CuCl2 | 加入过量的铁粉,过滤 |


