题目内容
【题目】我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到约800℃,可以得到一种外观似金子的锌和铜的合金。某同学在实验室按古代方法将炉甘石、赤铜和木炭粉混合加热一段时间,得到固体混合物A。对固体混合物A的成分进行如下实验探究。(资料:Cu2O+H2SO4=CuSO4+Cu+H2O)
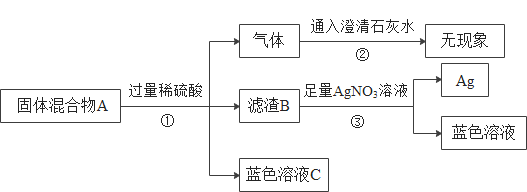
(1)固体混合物A中一定有_____,说明判断一定有的理由____。
(2)滤渣B 是_____,说明B一定有的来源____。
(3)设计实验证明固体混合物A中有铜,写出实验操作及预期现象____。
【答案】Zn、Cu2O 固体混合物A能与稀硫酸反应产生氢气和蓝色溶液 Cu 氧化亚铜 称取一定质量的固体混合物A,然后加入一定量且足量的稀硫酸,完全反应后,称取剩余物的质量,计算出氢气的质量,根据氢气的质量计算出参加反应的锌的质量,再将所得的物质过滤、洗涤、干燥、称量,用所得固体铜的质量计算氧化亚铜的质量,与A的质量减去锌的质量相比,若计算出的氧化亚铜的质量大于A的质量减去锌的质量,则存在铜。
【解析】
(1)固体混合物A加入过量的稀硫酸会产生气体,且不能与石灰水反应,因此固体混合物A中没有碳酸锌;根据实验现象,滤渣B和硝酸银溶液反应后得到的固体中只有银,因此固体混合物A中没有木炭粉;因为炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到约800℃,可以得到一种外观似金子的锌和铜的合金,根据实验现象产生的气体不能使澄清石灰水变浑浊,故该气体是氢气,A中一定含有锌;又因为固体混合物A加入过量的稀硫酸得到蓝色溶液C,由于铜不与硫酸反应,而氧化亚铜与稀硫酸反应生成硫酸铜,故可以推断A中一定含有氧化亚铜;虽然根据实验现象可以判断滤渣B是铜,但因为氧化亚铜与稀硫酸反应生成硫酸铜和铜,所以不能肯定固体混合物A中含有铜。综上所述,固体混合物A中一定有Zn、Cu2O,判断一定有的理由是:固体混合物A能与稀硫酸反应产生氢气和蓝色溶液。
(2)因为加入过量的稀硫酸,所以A中锌全部反应完,铜不与硫酸反应,氧化亚铜与稀硫酸反应生成硫酸铜、铜和水,铜能和硝酸银发生置换反应生成硝酸铜和银,所以滤渣B是铜,铜可能全部来自氧化亚铜,也可能部分来自氧化亚铜,部分来自甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到约800℃反应后生成的铜。故B一定有的来源是:氧化亚铜。
(3)要证明A中含有铜,可以称取一定质量的固体混合物A,然后加入一定量且足量的稀硫酸,完全反应后,称取剩余物的质量,计算出氢气的质量,根据氢气的质量计算出参加反应的锌的质量;再将反应后所得的物质过滤、洗涤、干燥、称量,假设所得固体铜全部来自于氧化亚铜和稀硫酸反应,根据所得固体铜的质量计算氧化亚铜的质量,与固体混合物A的质量减去锌的质量相比,若计算出的氧化亚铜的质量大于A的质量减去锌的质量,则存在铜。