题目内容
 A~H都是初中化学中常见的物质,已知B、F为固体化合物,其中F红色,D为红色固体单质,它们的转化关系如图所示.请回答:
A~H都是初中化学中常见的物质,已知B、F为固体化合物,其中F红色,D为红色固体单质,它们的转化关系如图所示.请回答:(1)物质D是
Cu
Cu
;物质E是CO
CO
;反应①的化学方程式为2CuO+C
2Cu+CO2↑
| ||
2CuO+C
2Cu+CO2↑
;
| ||
(2)写一个能实现反应④的化学方程式:
Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
;(3)某兴趣小组利用反应③在实验室制取物质G.根据所得的物质G的质量,可求得参加反应的物质E的质量,但实际消耗的物质E的质量远远超过计算值,其原因可能是(从实验过程分析,任意答一点)
实验开始要先通一氧化碳
实验开始要先通一氧化碳
.分析:由D为红色固体单质,且由黑色固体B与A在高温下反应生成,可判断D为金属铜、则B为氧化铜,以此为突破口,利用转化关系及各物质的性质与变化规律,可完成推断,得到判断结果:A为木炭、B为氧化铜、C为二氧化碳、D为铜、E为一氧化碳、F为氧化铁、G为铁、H为硫酸铜;进行验证,该推断结果符合题意.
解答:解:(1)由D为红色固体单质,且由黑色固体B与A在高温下反应生成,可判断D为金属铜、则B为氧化铜,C为二氧化碳,A为木炭,二氧化碳和碳在高温条件下生成一氧化碳,所以E为一氧化碳,反应①即高温条件下木炭还原氧化铜,反应的化学方程式为2CuO+C
2Cu+CO2↑;
(2)则反应④为铁粉与物质H反应生成红色固体单质铜,能实现反应④的化学方程式可为Fe+CuSO4=FeSO4+Cu;
(3)因为该实验开始要先通一氧化碳,目的是排净试管内的空气,当反应结束后还要继续通一氧化碳直到试管冷却,所以实际消耗的物质E的质量远远超过计算值.
故答案为:
(1)Cu;CO;2CuO+C
2Cu+CO2↑;
(2)Fe+CuSO4=FeSO4+Cu;
(3)实验开始要先通一氧化碳.
| ||
(2)则反应④为铁粉与物质H反应生成红色固体单质铜,能实现反应④的化学方程式可为Fe+CuSO4=FeSO4+Cu;
(3)因为该实验开始要先通一氧化碳,目的是排净试管内的空气,当反应结束后还要继续通一氧化碳直到试管冷却,所以实际消耗的物质E的质量远远超过计算值.
故答案为:
(1)Cu;CO;2CuO+C
| ||
(2)Fe+CuSO4=FeSO4+Cu;
(3)实验开始要先通一氧化碳.
点评:根据物质的颜色及特殊的反应条件作为推断的突破口,需要熟练掌握常见物质的颜色及对特殊反应条件的敏感性,这些都需要多加练习才能应用自如.

练习册系列答案
相关题目
 A~H都是初中化学中常见的物质,已知B为黑色固体,D为红色固体单质,F为红色固体,H溶液中的溶质是一种盐.它们的转化关系如图所示.请回答:
A~H都是初中化学中常见的物质,已知B为黑色固体,D为红色固体单质,F为红色固体,H溶液中的溶质是一种盐.它们的转化关系如图所示.请回答: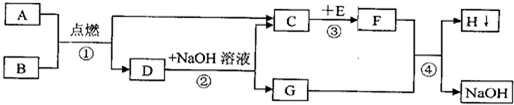
 (2010?夹江县二模)A~H都是初中化学中常见的物质,已知B为黑色固体,A中元素与组成自然界中最硬物质元素相同,D为红色固体金属单质,E--F为高炉炼铁中的主要反应之一,H溶液中的溶质是一种盐.它们的转化关系如图所示.请回答:
(2010?夹江县二模)A~H都是初中化学中常见的物质,已知B为黑色固体,A中元素与组成自然界中最硬物质元素相同,D为红色固体金属单质,E--F为高炉炼铁中的主要反应之一,H溶液中的溶质是一种盐.它们的转化关系如图所示.请回答: