题目内容
【题目】金属是一种非常重要的资源,在生产、生活中有着广泛的用途.
(1)人类向自然界提取量最大的金属是铁,高炉炼铁的原料是铁矿石,空气,石灰石和 ,
(2)如图所示,在盛水的试管中放一根洁净的铁钉,用带U形管的橡皮塞塞紧,U形管内水面处于同一高度,数天后观察到U形管内的a侧液面(填“上升”“下降”或“不变”),产生此现象的原因是 . 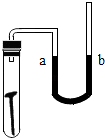
(3)请你提出一条防止钢铁锈蚀的合理措施 .
(4)在Cu(NO3)2、Al(NO3)3、和AgNO3的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体上滴加稀盐酸时有气泡产生,则反应所得溶液中含有的金属离子有 , 反应后溶液的质量比原混合溶液质量填(“大”或“小”),有关反应的化学方程式为(写一个即可).
(5)工业上可利用“铝热反应”焊接钢轨,冶炼难溶金属等,其原理是在高温下用铝将某些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?
【答案】
(1)焦炭
(2)上升;铁钉在潮湿的环境下和水氧气反应生锈,从而消耗了氧气,导致a侧液面上升
(3)刷漆
(4)Al3+、Fe 2+;小;Cu(NO3)2+Fe=Fe(NO3)2+Cu或者2AgNO3+Fe=2Ag+Fe(NO3)2或者Fe+2HCl=FeCl2+H2↑
(5)解:工业上可利用“铝热反应”焊接钢轨,冶炼难溶金属等,其原理是在高温下用铝将某些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,则对应的化学方程式为8Al+3Fe3O4 ![]() 4Al2O3+9Fe(配平时用最小公倍数法,从氧元素入手.或者说观察法).
4Al2O3+9Fe(配平时用最小公倍数法,从氧元素入手.或者说观察法).
设理论上需要消耗铝的质量是x
8Al+ | 3Fe3O4 |
| 4Al2O3+ | 9Fe |
8×27 | 9×56 | |||
x | 25.2kg |
![]() =
= ![]()
x=10.8kg
【解析】解:(1)人类向自然界提取量最大的金属是铁,高炉炼铁的原料是铁矿石,空气,石灰石和和焦炭;(2)在盛水的试管中放一根洁净的铁钉,环境潮湿,有水,也有空气,U形管内水面处于同一高度,数天后,慢慢生锈,生锈是消耗水和氧气的,导致a侧液面 上升,产生此现象的原因是 铁钉在潮湿的环境下和水氧气反应生锈,从而消耗了氧气,导致a侧液面上升.(3)请你提出一条防止钢铁锈蚀的合理措施 刷漆、抹油,做镀层或者加工为不锈钢(具体措施要结合物质的使用用途和环境以及价值来选择).(4)给定四种金属和氢的活动关系由高到低的顺序为为Al Fe H Cu Ag.在Cu(NO3)2、Al(NO3)3、和AgNO3的混合溶液中加入一定量的铁粉,充分反应(铁最先和硝酸银反应,然后和硝酸铜反应,不和硝酸铝反应)后过滤,向滤出的固体(一定有银和铜,可能有铁,一定无铝)上滴加稀盐酸时有气泡产生(说明固体有铁,也就是铁完全消耗掉硝酸银和硝酸铜后依然有剩余,),则反应所得溶液中含有的金属离子有铝粒子和亚铁粒子,无铜离子和银离子.混合物和铁反应分别为,且质量关系如下
Cu(NO3)2+ | Fe | = | Fe(NO3)2+ | Cu | 固体变化 |
56 | 64 | 56﹣64=﹣8 |
则溶解质量减小
或者
2AgNO3+ | Fe | = | Fe(NO3)2+ | 2Ag | 固体变化 |
56 | 216 | 56﹣218=﹣162 |
则溶解质量减小
反应后溶液的质量比原混合溶液质量 小.
有关反应的化学方程式为 Cu(NO3)2+Fe=Fe(NO3)2+Cu或者2AgNO3+Fe=2Ag+Fe(NO3)2
或者Fe+2HCl=FeCl2+H2↑(写一个即可).
所以答案是:(1)焦炭;(2)上升;铁钉在潮湿的环境下和水氧气反应生锈,从而消耗了氧气,导致a侧液面上升.(3)刷漆(合理即可).(4)Al 3+、Fe 2+;小; Cu(NO3)2+Fe=Fe(NO3)2+Cu或者2AgNO3+Fe=2Ag+Fe(NO3)2或者Fe+2HCl=FeCl2+H2↑(写一个即可).(5)10.8kg
【考点精析】关于本题考查的金属材料的选择依据和铁的冶炼,需要了解黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;铁冶炼的原料:铁矿石、焦炭、石灰石、空气;常见的铁矿石有磁铁矿(主要成分是Fe3O4 )、赤铁矿(主要成分是Fe2O3 )才能得出正确答案.

 备战中考寒假系列答案
备战中考寒假系列答案