��Ŀ����
����Ŀ��������ǯ��סһ������Ϊ12g�Ĵ���ʯ�����ھƾ�����ϸ�������Ƭ�̺���ʯ�����ס������ˣ�������Ӧ�Ļ�ѧ����ʽ�� ���û���Ӧ������ �������պ�Ĵ���ʯ��������������Ϊ7.6g�������ɵĶ�����̼Ϊ g���������ɵĶ�����̼ȫ��ͨ�������ij���ʯ��ˮ�У����Եõ���ɫ�������ٿˣ�
�������ɵĶ�����̼ͨ������������̿���У����Եõ�һ����̼����Ħ��������д��������̣�
���𰸡�CaCO3![]() CaO+CO2�����ֽⷴӦ��4.4g��
CaO+CO2�����ֽⷴӦ��4.4g��
���Եõ���ɫ������10g�����Եõ�һ����̼0.2Ħ����
������������ʯ����Ҫ�ɷ���̼��ƣ����·ֽ������������ƺͶ�����̼����Ӧ�ķ���ʽ�ǣ�CaCO3![]() CaO+CO2�����÷�Ӧ��һ�������������������ʣ����ڷֽⷴӦ��
CaO+CO2�����÷�Ӧ��һ�������������������ʣ����ڷֽⷴӦ��
�������غ㶨�ɿ�֪�����ɶ�����̼������Ϊ12g��7.6g=4.4g
�����ɵ�̼��Ƶ�����Ϊx
CO2+Ca��OH��2�TCaCO3��+H2O
44 100
4.4g x
![]() ��ã�x=10g
��ã�x=10g
������̼���ʵ���Ϊ��4.4g��44g/mol=0.1mol
�����ɵ�һ����̼���ʵ���Ϊy
CO2+C![]() 2CO��
2CO��
1 2
0.1mol y
![]() ��ã�y=0.2mol
��ã�y=0.2mol

����Ŀ���ܽ��������г���������ͬ������ˮ�е��ܽ�������ͬ��
���±���KNO3��NaCI�ڲ�ͬ�¶��µ��ܽ�ȣ���λ��g/100gˮ����
�¶ȣ��棩 | 0 | 20 | 40 | 60 | 80 | 100 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCI | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
���ϱ��е�����������40��ʱ�� ���ܽ�Ƚϴ�������Ӧ��������ʽ��ʾ���¶�ʱKNO3������Һ���������� ����Ҫ����㣩��
����д��һ�ֽ�KNO3�IJ�������Һת��Ϊ������Һ�ķ��� ��
��.20��ʱ����20g NaCl����50gˮ�У�������Һ�������� g��
������NaCl��Һ�еõ�NaCl����ķ����� ��
��������ͭ������ͼ��ʾ��ʵ�飬���������գ��ñ�ű�ʾ����
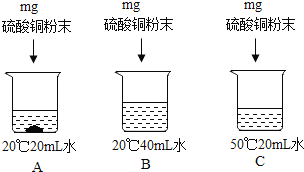
����������Һ�У�һ�����ڱ�����Һ���� ����Һ���ܼ������Ĵ�С��ϵ�� ��

