题目内容
某含杂质2%的石灰石样品(已知石灰石样品中含有的杂质不溶于水,也不与稀盐酸反应)与100g稀盐酸恰好完全反应,产生4.4g二氧化碳气体.请计算:反应后所得溶液的溶质质量分数.
解:设生成4.4g二氧化碳需要碳酸钙的质量为x,生成的氯化钙的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
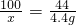 x=10g
x=10g
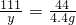 y=11.1g
y=11.1g
所得溶液的溶质质量分数为:
答:反应后所得溶液的溶质质量分数为10.5%.
分析:根据碳酸钙与稀盐酸反应的化学方程式进行分析解答,所得溶液中的溶质是生成的氯化钙,需要求出氯化钙的质量,同时需要求出反应后所得溶液的质量.
点评:本题考查了根据化学方程式的计算以及溶液的有关计算,完成此题,关键是求所得溶液的质量时,杂质和二氧化碳的质量不能计算在内.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
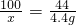 x=10g
x=10g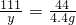 y=11.1g
y=11.1g所得溶液的溶质质量分数为:

答:反应后所得溶液的溶质质量分数为10.5%.
分析:根据碳酸钙与稀盐酸反应的化学方程式进行分析解答,所得溶液中的溶质是生成的氯化钙,需要求出氯化钙的质量,同时需要求出反应后所得溶液的质量.
点评:本题考查了根据化学方程式的计算以及溶液的有关计算,完成此题,关键是求所得溶液的质量时,杂质和二氧化碳的质量不能计算在内.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目