题目内容
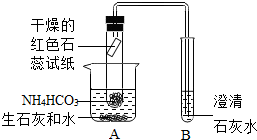 (2009?普宁市一模)小明暑假期间到农田施肥时,发现撒落在地上的碳酸氢铵在阳光的照射下很快消失了,同时有浓烈的刺激性气味.他很好奇,返校后和同学们进行探究,请你一同参与:
(2009?普宁市一模)小明暑假期间到农田施肥时,发现撒落在地上的碳酸氢铵在阳光的照射下很快消失了,同时有浓烈的刺激性气味.他很好奇,返校后和同学们进行探究,请你一同参与:【提出问题】温度较高时,碳酸氢铵能分解吗?产物是什么?
【猜想假设】碳酸氢铵受热易分解,产物可能为水、二氧化碳、氨气.
【实验设计】小明设计了如图所示的装置进行实验(夹持装置省略).
(1)根据现象
干燥的红色石蕊试纸变蓝
干燥的红色石蕊试纸变蓝
,证明实验后生成了水和氨气.(2)装置B中澄清石灰水
变浑浊
变浑浊
,证明产物中有二氧化碳生成.(3)小红同学认为若将装置B中澄清石灰水改为NaOH溶液,再通过实验验证B中产物,也可以证明碳酸氢铵分解后有二氧化碳生成.请你帮她设计并完成验证B中产物的实验:
| 实验步骤 | 实验现象 | 反应的化学方程式 |
NH4HCO3
NH3↑+H2O+CO2↑.
| ||
NH4HCO3
NH3↑+H2O+CO2↑.
.
| ||
【实验评价】在上述同学们探究活动中,你最欣赏
小明同学用生石灰和水反应放出的热量做热源
小明同学用生石灰和水反应放出的热量做热源
.【实验反思】根据以上实验,你认为碳酸氢铵化肥在存放时应注意
避光、避热、密封.
避光、避热、密封.
.分析:(1)氨气能使湿润的红色石蕊试纸变蓝;利用干燥的红色石蕊试纸的颜色变化,可同时检验分解生成的氨气和水;
(2)实验室使用澄清石灰水检验气体为二氧化碳,二氧化碳能使澄清石灰水反应生成水的沉淀碳酸钙而变浑浊;根据澄清石灰水的变化可检验气体中的二氧化碳;
(3)氢氧化钠溶液吸收二氧化碳生成碳酸钠和水,由于没有不溶性固体,因此变化无明显现象而不能判断气体中含有二氧化碳;但由于氢氧化钠与反应生成的碳酸钠性质有很大不同,可采取验证碳酸钠或碳酸根的方法证明气体中含有二氧化碳;利用碳酸钠可与盐酸、氯化钙溶液、氢氧化钡溶液等发生反应,检验溶液中含有碳酸钠,从而证明二氧化碳气体;
[实验结论]根据探究,可得知碳酸氢铵受热可分解生成具有氨臭味的氨气、水和能使澄清石灰水变浑浊的气体二氧化碳,据此写出分解反应的化学方程式;
[实验评价]加热碳酸氢铵分解时,小明同学采取了特别的措施:生石灰遇水放出大量的热;检验生成的二氧化碳时,小红同学创新地使用了氢氧化钠溶液;这些都可称为值得欣赏的设计;
[实验反思]根据碳酸氢铵的性质:见光或受热易分解,设计保存该药品的方法.
(2)实验室使用澄清石灰水检验气体为二氧化碳,二氧化碳能使澄清石灰水反应生成水的沉淀碳酸钙而变浑浊;根据澄清石灰水的变化可检验气体中的二氧化碳;
(3)氢氧化钠溶液吸收二氧化碳生成碳酸钠和水,由于没有不溶性固体,因此变化无明显现象而不能判断气体中含有二氧化碳;但由于氢氧化钠与反应生成的碳酸钠性质有很大不同,可采取验证碳酸钠或碳酸根的方法证明气体中含有二氧化碳;利用碳酸钠可与盐酸、氯化钙溶液、氢氧化钡溶液等发生反应,检验溶液中含有碳酸钠,从而证明二氧化碳气体;
[实验结论]根据探究,可得知碳酸氢铵受热可分解生成具有氨臭味的氨气、水和能使澄清石灰水变浑浊的气体二氧化碳,据此写出分解反应的化学方程式;
[实验评价]加热碳酸氢铵分解时,小明同学采取了特别的措施:生石灰遇水放出大量的热;检验生成的二氧化碳时,小红同学创新地使用了氢氧化钠溶液;这些都可称为值得欣赏的设计;
[实验反思]根据碳酸氢铵的性质:见光或受热易分解,设计保存该药品的方法.
解答:解:(1)氨气与水反应生成氨水呈碱性,能使红色石蕊试纸变蓝,而氨气不能使红色石蕊试纸变蓝;因此,观察到干燥的红色石蕊试纸变蓝色时,可以说明反应分解生成氨气和水;
故答案为:干燥的红色石蕊试纸变蓝;
(2)实验室使用澄清石灰水检验气体二氧化碳,二氧化碳能与澄清石灰水反应生成不溶于水的沉淀碳酸钙而变浑浊;根据澄清石灰水的变化可检验气体中的二氧化碳;
故答案为:变浑浊;
③二氧化碳与氢氧化钠反应生成碳酸钠和水,反应无明显现象,因此无法直接说明气体中含有二氧化碳;可采取检验溶液中含有碳酸钠的方法间接地证明气体中存在二氧化碳;根据碳酸钠与氢氧化钠性质的不同,可采取滴加稀盐酸、氯化钙溶液或氢氧化钡溶液等方法检验碳酸钠;
故答案为:
【实验结论】碳酸氢铵受热分解,生成氨气、水和二氧化碳气体;
故答案为:NH4HCO3
NH3↑+H2O+CO2↑.
【实验评价】在加热碳酸氢铵时,小明同学并没有使用通常所使用的酒精灯,而是采取用生成灰加水放出大量热的方法,该方法既做到了加热的目的,又不使用燃料节约能源减少排放;
故答案为:小明同学用生石灰和水反应放出的热量做热源(或小红同学验证二氧化碳的方法);
【实验反思】根据:碳酸氢铵在阳光的照射下很快消失了放出氨气,受热易分解生成氨气,因此,在保存碳酸氢铵时应避开阳光的直接照射、应避免放在温度较高处;
故答案为:避光、避热、密封.
故答案为:干燥的红色石蕊试纸变蓝;
(2)实验室使用澄清石灰水检验气体二氧化碳,二氧化碳能与澄清石灰水反应生成不溶于水的沉淀碳酸钙而变浑浊;根据澄清石灰水的变化可检验气体中的二氧化碳;
故答案为:变浑浊;
③二氧化碳与氢氧化钠反应生成碳酸钠和水,反应无明显现象,因此无法直接说明气体中含有二氧化碳;可采取检验溶液中含有碳酸钠的方法间接地证明气体中存在二氧化碳;根据碳酸钠与氢氧化钠性质的不同,可采取滴加稀盐酸、氯化钙溶液或氢氧化钡溶液等方法检验碳酸钠;
故答案为:
| 实验步骤 取装置B中溶液少许,滴加稀盐酸(或滴加氯化钙溶液或氢氧化钡溶液) |
实验现象 产生气泡(或产生白色沉淀) |
反应的化学方程式 Na2CO3+2HCl═2NaCl+CO2↑+H2O [或Na2CO3+CaCl2═CaCO3↓+2NaCl Na2CO3+Ba(OH)2═BaCO3↓+2NaOH] |
故答案为:NH4HCO3
| ||
【实验评价】在加热碳酸氢铵时,小明同学并没有使用通常所使用的酒精灯,而是采取用生成灰加水放出大量热的方法,该方法既做到了加热的目的,又不使用燃料节约能源减少排放;
故答案为:小明同学用生石灰和水反应放出的热量做热源(或小红同学验证二氧化碳的方法);
【实验反思】根据:碳酸氢铵在阳光的照射下很快消失了放出氨气,受热易分解生成氨气,因此,在保存碳酸氢铵时应避开阳光的直接照射、应避免放在温度较高处;
故答案为:避光、避热、密封.
点评:铵根的检验:取样品与氢氧化钠混合,加热,能产生具有氨臭味且能使湿润红色石蕊试纸变蓝的气体,说明样品含铵根;
碳酸根的检验:取样滴加盐酸,产生气体通入澄清石灰水,石灰水变浑浊,说明样品含碳酸根.
碳酸根的检验:取样滴加盐酸,产生气体通入澄清石灰水,石灰水变浑浊,说明样品含碳酸根.

练习册系列答案
相关题目
 (2009?普宁市一模)如图是a、b两种固体物质的溶解度曲线,小明同学对此图进行分析时得到了下列信息,你认为正确的是( )
(2009?普宁市一模)如图是a、b两种固体物质的溶解度曲线,小明同学对此图进行分析时得到了下列信息,你认为正确的是( )