题目内容
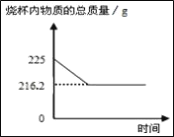
【题目】某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,准确称取25g放于盛有200g稀盐酸的烧杯中(杂质不溶于水,也不与稀盐酸反应,也不分解),恰好完全反应。测得烧杯内物质的总质量与时间的关系如图所示(气体溶解忽略不计),试计算:
(1)石灰石中碳酸钙的质量分数是多少?_____
(2)完全反应后所得溶液的溶质质量分数是多少?_____
【答案】80% 10.5%
【解析】
根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算碳酸钙的质量和生成氯化钙的质量,进而求算对应质量分数。
解:根据质量守恒定律可得,生成二氧化碳的质量为225g﹣216.2g=8.8g
设该石灰石样品中碳酸钙的质量为x,生成氯化钙的质量为z
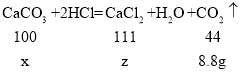
![]()
x=20g
z=22.2g
(1)石灰石中碳酸钙的质量分数是![]()
(2)完全反应后所得溶液的溶质质量分数为![]()
答:(1)石灰石中碳酸钙的质量分数是80%;
(2)完全反应后所得溶液的溶质质量分数为10.5%。

练习册系列答案
相关题目