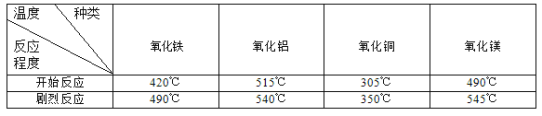
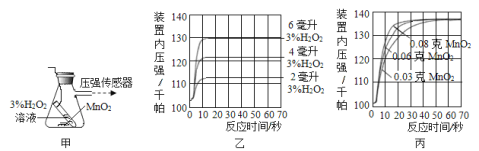
题目内容
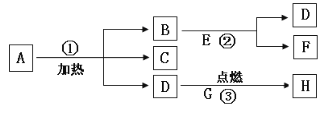
【题目】实验室中,利用下列装置可以制取某些气体,请回答下列问题。
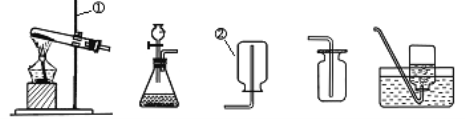
A B C D E
(1)写出带标号的仪器的名称:① ;② ;
(2)向气体发生装置内加入药品前,必须 ;
(3)a实验室若用高锰酸钾制取氧气,选择的制取装置是 ;b实验室若用双氧水制氧气的反应符号表达式为 ,反应中,MnO2起 作用,加快了H2O2的分解。
(4)乙炔(C2H2)又称电石气,是一种无色.无味.密度比空气略小,不溶于水的气体;工业上常用它燃烧产生的高温来切割和焊接金属;实验室用电石(固体)与水反应制取乙炔。你认为制取乙炔应选择的发生装置是 ;收集装置是 ;
(5)甲烷(CH4)在实验室里可用排水法或向下排空气法收集,请你根据甲烷的收集方法,推测该气体具有的性质是_________________ _____。
【答案】(1)①铁架台②集气瓶(2)检查装置的气密性(3)A;2H2O2![]() 2H2O+O2↑;催化作用(4)B;E(5)难溶于水或者密度小于空气。
2H2O+O2↑;催化作用(4)B;E(5)难溶于水或者密度小于空气。
【解析】
试题分析:向气体发生装置内加入药品前,必须检查装置的气密性,防止漏气;实验室若用高锰酸钾制取氧气,选择的发生装置是A,因为过程中需要加热;收集装置可以是D或者E,因为氧气变易溶于水而且密度大于空气;实验室若用双氧水制氧气的反应符号表达式为2H2O2![]() 2H2O+O2↑,反应中,MnO2起催化作用,加快了H2O2的分解。实验室用电石(固体)与水反应制取乙炔。制取乙炔应选择的发生装置是B,因为过程中不要加热;收集装置是E,因为;乙炔(C2H2)又称电石气,是一种无色.无味.密度比空气略小,不溶于水的气体;甲烷(CH4)在实验室里可用排水法或向下排空气法收集,甲烷的收集方法,推测该气体具有的性质是难溶于水或者密度小于空气。
2H2O+O2↑,反应中,MnO2起催化作用,加快了H2O2的分解。实验室用电石(固体)与水反应制取乙炔。制取乙炔应选择的发生装置是B,因为过程中不要加热;收集装置是E,因为;乙炔(C2H2)又称电石气,是一种无色.无味.密度比空气略小,不溶于水的气体;甲烷(CH4)在实验室里可用排水法或向下排空气法收集,甲烷的收集方法,推测该气体具有的性质是难溶于水或者密度小于空气。

练习册系列答案
相关题目