题目内容
【题目】在实验室中通常用氯酸钾和二氧化锰的混合物来制取氧气。在工业上,通过如下转化可制得KClO3晶体:![]() 。
。
(1)完善过程Ⅰ中反应的化学方程式:NaCl+3H2O![]() NaClO3 +3_______。
NaClO3 +3_______。
(2)操作Ⅱ的名称为________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是___________________。
(3)滤液中所含的溶质有_______________________(少填或多填均不得分)。
【答案】H2过滤室温下氯酸钾在水中的溶解度明显小于其他晶体KCl、NaCl、KClO3
【解析】
(1)在化学反应前后,原子个数不变,所以NaCl+3H2O![]() NaClO3+3H2↑;
NaClO3+3H2↑;
(2)分离液体与固体应用过滤的方法;相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度明显小于其它晶体,所以先析出KClO3;
(3)通过分析可知,![]() ,所以母液中的所有溶质的化学式为:KCl、NaCl、KClO3;
,所以母液中的所有溶质的化学式为:KCl、NaCl、KClO3;

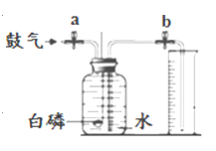
【题目】空气是一种宝贵的自然资源。某兴趣小组的同学在实验室欲用下图所示装置粗略测定空气中氧气的含量。
(实验回顾)
(1)写出红磷燃烧的文字表达式:____________。
(2)实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内____________减小,烧杯中水倒吸到集气瓶。若装置的气密性良好,操作规范,用量筒测量进入瓶中水的体积,能粗略测得空气中氧气的含量。
(提出问题)有实验资料表明:燃烧过程中当氧气体积分数低于7% 时,红磷就无法继续燃烧,因此通过上述实验,测定结果与理论值误差较大。那么,能否设计一套实验装置使测定结果更为准确呢?
(查阅资料)铁生锈的原理是:铁与空气中的氧气和水蒸气等发生化学反应。饱和食盐水、活性炭会加速铁生锈。
(实验改进)方案一:Ⅰ.同学们根据铁在空气中生锈的原理设计如图的实验装置,再次测定空气中氧气含量。

Ⅱ.测得实验数据如下表:
测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的体积 | |
体积/ml | 80.0 | 54.5 | 126.0 |
(交流表达)
(3)从实验原理角度分析,改进后的实验结果比前者准确度更高的原因是:①_______________;②____________。
方案二:同学们又设计了下图所示的实验装置,实验步骤如下(装置气密性良好,部分操作已略去):
Ⅰ.打开止水夹a和b,向集气瓶中缓慢鼓入一定量空气,至白磷与空气接触,测得进入量筒中水的体积为V1;II.关闭a和b强光照射引燃白磷;III.白磷熄灭并冷却至室温,打开止水夹b测得量筒中水的体积变为V2;IV.计算空气中氧气的体积分数。步骤IV中,求得氧气的体积分数等于___。