题目内容
【题目】(14分)人类的生产和生活都离不开金属。
Ⅰ.金属元素在自然界中分布很广,在地壳中主要以矿物形式存在。下列矿石的主要成分不属于氧化物的是 (填序号),孔雀石中铜元素的化合价 ;如将一定量的铁加入到硫酸铜和硫酸锌的混合溶液中,充分反应后,滤液中一定含有的溶质是 ,滤渣中一定含有 。

Ⅱ.铁是应用最广泛的金属。
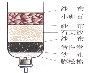
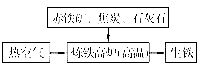
(1)下图是工业炼铁示意图。其中,焦炭的作用是燃烧提供能量和 ;写出有铁生成的化学方程式为 。
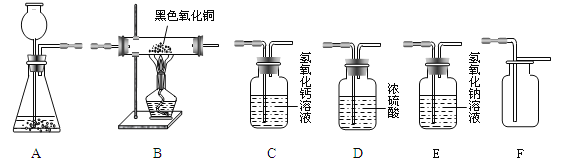
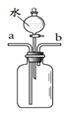
(2)某兴趣小组在实验室中模拟炼铁的化学原理,用一氧化碳还原纯净的氧化铁粉末,实验装置如图。
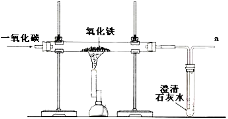
①实验中玻璃管里固体粉末的颜色变化是 ,澄清的石灰水中发生反应的化学方程式是 。
②该装置有何不妥? 。
(3)该化学兴趣小组的同学利用改正后的装置对一份由铁粉和氧化铁组成的混合物进行探究。他们取了7.2g固体样品放入硬质玻璃管通入足量的CO进行实验,高温灼烧至质量不再变化,称得玻璃管中固体质量为6g,请计算:
①该混合物中铁元素与氧元素的质量比。(1分)
②该混合物中铁粉的质量分数。(结果保留一位小数)(2分)
【答案】Ⅰ. B;+2;硫酸亚铁和硫酸锌;铜Ⅱ(1)制得CO ;Fe2O3 + 3CO![]() 2Fe + 3CO2(2)红色粉末逐渐变为黑色;Ca(OH)2+CO2===H2O+CaCO3↓②没有尾气的处理装置(3)① Fe:O=5:1②44.4 %
2Fe + 3CO2(2)红色粉末逐渐变为黑色;Ca(OH)2+CO2===H2O+CaCO3↓②没有尾气的处理装置(3)① Fe:O=5:1②44.4 %
【解析】
试题分析:根据氧化物的概念可以知道B不是氧化物,因为其中含有四种元素,由于铁金属活动性大于铜小于锌,所以能够发生的反应是铁和硫酸铜,所以最终溶液中有:硫酸亚铁和硫酸锌,铁过量所以最后铁剩余,同滤渣中还含有生产的铜,炼铁的原理是铁矿石和CO反应,所以焦炭的作用之一就是制备CO,由于生产的铁常是黑色,所以反应的现象是红色粉末逐渐变为黑色,过程中使用了CO,而它是一种有害气体,所以应该有尾气处理装置,防止进入大气中污染空气,反应结束后氧化铁完全转变为铁,所以最终的6克就是铁的质量,原来7.2克中除了铁元素外只有氧元素,所以混合物中氧元素的质量=7.2-6=1.2克,混合物中铁元素与氧元素的质量比=6:1.2=5:1;氧元素只在氧化铁中含有,所以设氧化铁的质量为X,则:X×48/160×100%=1.2克 X=4克,则原混合物中铁的质量为=7.2-4=3.2克,混合物中铁粉的质量分数=3.2/7.2×100%=44.4%

 名校课堂系列答案
名校课堂系列答案