题目内容
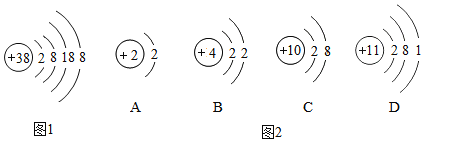
【题目】A-I是初中化学常见的物质,已知变化①的现象是物质颜色由黑变红,C可用在铅蓄电池中,H为天然气的主要成分,它们的相互转化关系如图所示(部分反应物、生成物及反应条件已略去)。请回答下列问题:

(1)物质C的化学式_______。
(2)反应③的基本反应类型________。
(3)物质D的一种用途_______。
(4)反应②的化学方程式为________。
【答案】H2SO4 置换反应 灭火(答案合理即可) ![]()
【解析】
A、B反应的现象是物质的颜色由黑变红,反应①是黑色的碳和氧化铜反应生成红色的铜和无色的气体二氧化碳,化学方程式是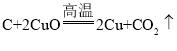 ,A与I反应生成D,化学方程式是
,A与I反应生成D,化学方程式是 ,A是碳,B是氧化铜,D是二氧化碳,G是铜,I是氧气;C可用在铅酸蓄电池中,C是硫酸,反应②是B(CuO)与C(H2SO4)反应生成硫酸铜和水,化学方程式是
,A是碳,B是氧化铜,D是二氧化碳,G是铜,I是氧气;C可用在铅酸蓄电池中,C是硫酸,反应②是B(CuO)与C(H2SO4)反应生成硫酸铜和水,化学方程式是![]() ,E是硫酸铜,F是水;H是天然气的主要成分,是甲烷,H(甲烷)与I(氧气)通过反应④生成D(二氧化碳)、F(水),化学方程式是
,E是硫酸铜,F是水;H是天然气的主要成分,是甲烷,H(甲烷)与I(氧气)通过反应④生成D(二氧化碳)、F(水),化学方程式是 ;E(硫酸铜)通过反应③得到G(铜),化学方程式是
;E(硫酸铜)通过反应③得到G(铜),化学方程式是![]() ;
;
(1)由以上分析,物质C是硫酸,化学式是H2SO4;
故填:H2SO4。
(2)反应③的化学方程式是![]() ,是一种单质和一种化合物反应生成另一种单质和另一种化合物,基本反应类型是置换反应;
,是一种单质和一种化合物反应生成另一种单质和另一种化合物,基本反应类型是置换反应;
故填:置换反应。
(3)物质D是二氧化碳,二氧化碳的用途有:①灭火;②气体肥料;③化工原料;
故填:灭火(合理即可)。
(4)反应②是氧化铜与硫酸反应生成硫酸铜和水,化学方程式是![]() ;
;
故填:![]() 。
。

 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案【题目】实验室现有氯化镁和氯化钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数,先称取该混合物样品20g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液200g平均分四次加入其中,充分振荡,实验所得数据见下表。
请你分析并进行有关计算:(提示:氯化镁与氢氧化钠反应生成氢氧化镁沉淀和氯化钠)
次数 | 1 | 2 | 3 | 4 |
加入氢氧化钠溶液的质量/g | 50 | 50 | 50 | 50 |
生成沉淀的质量/g | 2.9 | x | 8.7 | 8.7 |
(1)第_____次氯化镁和氢氧化钠刚好完全反应。
(2)原固体混合物样品中氯化镁的质量分数是多少?_____(要求有完整的计算过程)
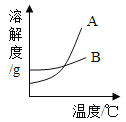
【题目】根据下面提供的溶解度表和溶解度曲线回答相关问题:
温度/℃ | 10 | 30 | 50 | 60 | 100 | |
溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 | 39.8 |
硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | 246 | |
(1)A是_____的溶解度曲线(填“氯化钠”或“硝酸钾”);
(2)100℃时,100g水中加入200g硝酸钾,所得溶液是_____(填“饱和”或“不饱和”)溶液,将此溶液从100℃降温到60℃时,析出晶体的质量______g。