题目内容
金属在生产、生活中有广泛的用途。
(1)下图金属制品中,利用金属的物理性质有导热性、导电性和 。

铁锅 铜导线 铝箔
(2)下列四个实验中,铁钉最易生锈的是(填序号) 。
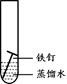
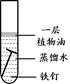
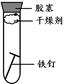
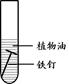
A B C D
(3)工业常用赤铁矿(主要成分为氧化铁)和一氧化碳在高温条件下炼铁,该反应的化学方程式为 。
(4)某同学将带锈铁钉放入稀盐酸中,观察到铁锈逐渐消失,溶液由无色逐渐变成黄色,并有气泡产生,有关反应的化学方程式为 。
(5)将盛有等质量、等溶质质量分数的稀盐酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的锌和铁,待反应停止后,请判断:若天平仍保持平衡,烧杯中一定没有剩余的物质是 ;若天平失去平衡,则指针偏向的一侧的烧杯中溶液中的溶质是 。
(1)下图金属制品中,利用金属的物理性质有导热性、导电性和 。

铁锅 铜导线 铝箔
(2)下列四个实验中,铁钉最易生锈的是(填序号) 。




A B C D
(3)工业常用赤铁矿(主要成分为氧化铁)和一氧化碳在高温条件下炼铁,该反应的化学方程式为 。
(4)某同学将带锈铁钉放入稀盐酸中,观察到铁锈逐渐消失,溶液由无色逐渐变成黄色,并有气泡产生,有关反应的化学方程式为 。
(5)将盛有等质量、等溶质质量分数的稀盐酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的锌和铁,待反应停止后,请判断:若天平仍保持平衡,烧杯中一定没有剩余的物质是 ;若天平失去平衡,则指针偏向的一侧的烧杯中溶液中的溶质是 。
(1)延展性
(2)A
(3)Fe2O3 + 3CO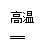 2Fe + 3CO2
2Fe + 3CO2
(4)Fe2O3 + 6HCl=2FeCl3 + 3H2O Fe + 2HCl= FeCl2 + H2↑(2分)
(5)HCl HCl和ZnCl2 (化学式、名称均可)
(2)A
(3)Fe2O3 + 3CO
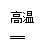 2Fe + 3CO2
2Fe + 3CO2(4)Fe2O3 + 6HCl=2FeCl3 + 3H2O Fe + 2HCl= FeCl2 + H2↑(2分)
(5)HCl HCl和ZnCl2 (化学式、名称均可)
:(1)铁锅是利用铁的导热性,铜导线是利用铜的导电性,铝箔是利用铝的延展性
(2)铁生锈的条件是与氧气、水共同接触,所以铁钉最易生锈的是A
(3)反应物是一氧化碳和氧化铁,生成物是铁和二氧化碳,根据得失氧进行配平,反应条件是高温写在等号的上边
(4)将带锈铁钉放入稀盐酸,盐酸先与氧化铁反应,生成氯化铁和水,用观察法配平,把铁锈反应完,再与内部的铁反应,反应物是铁和盐酸,生成物是氯化亚铁和氢气,用观察法配平,氢气后面标上上升符号
(5)等质量的铁和锌与足量盐酸反应生成氢气的质量大小是:铁产生的氢气大于锌产生的氢气,若天平仍保持平衡,说明产生氢气相同,说明金属并没有全部反应完,把盐酸全部反应完了,因为盐酸质量和质量分数相等,所以产生氢气相同,所以盐酸没有剩余;因为等质量的铁和锌与足量盐酸反应,铁产生的氢气大于锌产生的氢气,所以偏向锌的一边,所以若天平失去平衡,则指针偏向的一侧的烧杯中溶液中的溶质是锌与盐酸反应生成的氯化锌和过量的氯化氢.
(2)铁生锈的条件是与氧气、水共同接触,所以铁钉最易生锈的是A
(3)反应物是一氧化碳和氧化铁,生成物是铁和二氧化碳,根据得失氧进行配平,反应条件是高温写在等号的上边
(4)将带锈铁钉放入稀盐酸,盐酸先与氧化铁反应,生成氯化铁和水,用观察法配平,把铁锈反应完,再与内部的铁反应,反应物是铁和盐酸,生成物是氯化亚铁和氢气,用观察法配平,氢气后面标上上升符号
(5)等质量的铁和锌与足量盐酸反应生成氢气的质量大小是:铁产生的氢气大于锌产生的氢气,若天平仍保持平衡,说明产生氢气相同,说明金属并没有全部反应完,把盐酸全部反应完了,因为盐酸质量和质量分数相等,所以产生氢气相同,所以盐酸没有剩余;因为等质量的铁和锌与足量盐酸反应,铁产生的氢气大于锌产生的氢气,所以偏向锌的一边,所以若天平失去平衡,则指针偏向的一侧的烧杯中溶液中的溶质是锌与盐酸反应生成的氯化锌和过量的氯化氢.

练习册系列答案
相关题目



