题目内容
(2008?聊城)把12g铁片放入50g稀硫酸中,充分反应后称得剩余铁片的质量为6.4g.请计算:(1)生成氢气的质量;
(2)稀硫酸的质量分数.
【答案】分析:根据金属活动性可知,铁可以与稀硫酸发生置换反应生成硫酸亚铁和氢气;充分反应后铁有剩余,可判断稀硫酸已完全反应;根据反应的化学方程式,由参加反应铁的质量可计算生成氢气的质量和参加反应的硫酸的质量;
最后使用稀硫酸的质量分数=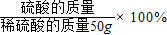 ,可计算稀硫酸的质量分数.
,可计算稀硫酸的质量分数.
解答:解:参加反应的铁的质量12g-6.4g=5.6g
设生成氢气的质量为x,硫酸的质量为y
Fe+H2SO4═FeSO4+H2↑
56 98 2
5.6g y x
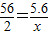 x=0.2g
x=0.2g
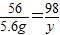 y=9.8g
y=9.8g
稀硫酸的质量分数=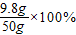 =19.6%
=19.6%
答:(1)生成氢气的质量是0.2g;(2)稀硫酸的质量分数为19.6%.
点评:利用化学方程式可以表示各物质的质量关系,由反应中某一物质的质量可计算反应中其它物质的质量.
最后使用稀硫酸的质量分数=
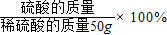 ,可计算稀硫酸的质量分数.
,可计算稀硫酸的质量分数.解答:解:参加反应的铁的质量12g-6.4g=5.6g
设生成氢气的质量为x,硫酸的质量为y
Fe+H2SO4═FeSO4+H2↑
56 98 2
5.6g y x
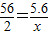 x=0.2g
x=0.2g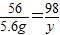 y=9.8g
y=9.8g稀硫酸的质量分数=
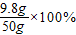 =19.6%
=19.6%答:(1)生成氢气的质量是0.2g;(2)稀硫酸的质量分数为19.6%.
点评:利用化学方程式可以表示各物质的质量关系,由反应中某一物质的质量可计算反应中其它物质的质量.

练习册系列答案
相关题目