题目内容
【题目】某研究性学习小组,选择“过氧化氢(H202)生成氧气(02)的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程。
【假设】过氧化氢生成氧气的快慢与催化剂的种类有关。
【实验方案】常温下,在两瓶相同体积的过氧化氢(H202)溶液中分别加入相同质量的二氧化锰(MnO2)和红砖粉,测量各生成一瓶(相同体积)氧气所需的时间。
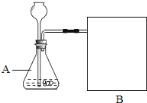
【进行实验】上图是他们进行实验的装置图,气体发生装置中A仪器的名称是__________ ,此实验中B处宜采用的气体收集方法是_______________。
【实验记录】
实验编号 | 1 | 2 |
反应物 | 6%过氧化氢(H202) | 6%过氧化氢(H202) |
催化剂 | 1g 二氧化锰 | |
时间 | 35s | 152s |
【结论】该探究过程得出的结论是__________________________
【反思】过氧化氢在常温下分解缓慢,加入二氧化锰或红砖粉后反应明显加快,若要证明二氧化锰(MnO2)和红砖粉是该反应的催化剂,还需增加实验来验证它们在化学反应前后的 ________ 和 ________ 是否改变。
【答案】【进行实验】锥形瓶、排水法
【实验记录】
实验编号 | 1 | 2 |
反应物 | 6%过氧化氢(H202) | 6%过氧化氢(H202) |
催化剂 | 1g二氧化锰 | 1g红砖粉 |
时间 | 35s | 152s |
【结论】过氧化氢生成氧气的快慢与催化剂的种类有关
【反思】质量;化学性质
【解析】
试题分析:此实验中B处宜采用的气体收集方法是排水法,因为排水法能够获得更加纯净的氧气,常温下,在两瓶相同体积的过氧化氢(H202)溶液中分别加入相同质量的二氧化锰(MnO2)和红砖粉,测量各生成一瓶(相同体积)氧气所需的时间。所以实验2中提供的物质是红砖粉,探究过程得出的结论是过氧化氢生成氧气的快慢与催化剂的种类有关;过氧化氢在常温下分解缓慢,加入二氧化锰或红砖粉后反应明显加快,若要证明二氧化锰(MnO2)和红砖粉是该反应的催化剂,还需增加实验来验证它们在化学反应前后的质量和化学性质是否改变。