题目内容
【题目】下列关于原子结构的说法,正确的是 ( )
A. 任何原子都是由质子,中子和电子三种粒子构成。
B. 原子的核电荷数=质子数=中子数=核外电子数
C. 原子是由原子核和核外电子构成的
D. 原子对外不显电性是因为原子中不存在带点粒子
【答案】C
【解析】A. 氢原子没有中子,错误;B. 原子的核电荷数=质子数=核外电子数,不一定等于中子数,错误;C. 原子是由原子核和核外电子构成的,正确;D. 原子对外不显电性是因为原子中质子数=核外电子数,错误。故选C。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】探究学习小组在实验室中用图1所示装置制取CO2并探究CO2与过氧化钠(Na2O2)的反应.
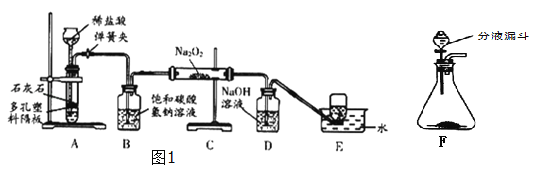
查阅资料得知:过氧化钠(Na2O2)是一种淡黄色固体,能与CO2,H2O发生反应:Na2O2+2CO2═2Na2CO3+O2,2Na2O2+H2O═4NaOH+O2↑
请回答下列问题:
(1)装置A中发生反应的化学方程式为________________________,利用装置A制取CO2的优点是___________________________________.
(2)装置B的作用是吸收CO2中混有的HCl,发生反应化学方程式为____________________________
(3)装置D的作用是_______________________.
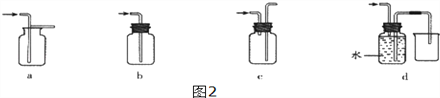
(4)装置E中收集到的气体是____(填化学式),该气体还可以用下列图2装置中的______进行收集(填写字母序号).
(5)为探究反应后装置C硬质玻璃管中固体的成分,该小组同学进行了如图3实验: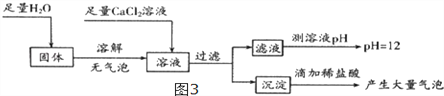
根据固体加水溶解无气泡,得出__________________________结论,加入足量氯化钙目的为
_______________________________________,根据判断,反应后装置C硬质玻璃管中固体为
______________________.
(6)①在实验室制取二氧化碳的研究中,探究学习小组又进行了如下实验:
药品编号 | 甲 | 乙 | 丙 | 丁 |
大理石 | m g,块状 | m g,块状 | m g,粉末状 | m g,粉末状 |
盐酸(过量) | w g,稀盐酸 | w g,浓盐酸 | w g,稀盐酸 | w g,浓盐酸 |
I.若要研究盐酸浓度大小对反应的影响,可选择实验甲与______对照(选填实验编号)。
II..除盐酸的浓度外,上述实验研究的另一个影响反应的因素是_____________________。
III.研究发现酸的浓度越大,产生气体的速度越快,与甲比较,对丁分析正确的是______(选填编号)
A、反应更为剧烈 B、最终剩余溶液的质量更小
C、产生的二氧化碳的质量更大 D、粉末状大理石利用率更高
②下表中的两个实验,尽管在原料状态、发生装置等方面存在差异,却都能控制气体较平稳地产生。请从实验目的、原理、原料、装置、操作等方面思考后,具体阐述每个实验中气体较平稳产生的最主要的一个原因。
目的 | 原料 | 发生装置 | 气体较平稳产生的 最主要的一个原因 |
制取二氧化碳 | 块状大理石稀盐酸 | A | ______________________ |
制取氧气 | 粉末状二氧化碳3%的过氧化氢溶液 | F | ________________________ |
【题目】矿泉水中元素及国标含量如表所示,请用化学用语回答下列问题.
矿物质水中主要成分(mg/1L) | |
偏硅酸(H2SiO3)≥25 | 钙≥0.2 |
硫酸根≥0.05 | 钠≥0.2 |
氯离子≤5 | 镁≥0.2 |
①矿泉水中含有的镁元素 ______ ;
②久置的水中溶有一定量的氧气,请表示出n个氧分子 ______ ;
③表中的一种阴离子 ______ ;
④硫酸钙中钙元素的化合价 ______ .
