题目内容
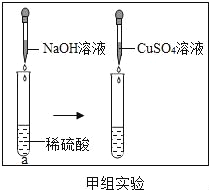
【题目】有一白色固体X,其主要成分是氯化钠,可能含有碳酸钙、氯化钙、硫酸铜和氢氧化钙。为探究其组成进行如下实验,主要流程及现象记录如下:

回答下列问题:
(1)根据步骤①实验现象确定白色固体X中一定没有_______;
(2)步骤②中发生反应的化学方程式____________________ ;
(3)步骤③中产生白色沉淀A的化学方程式____________________ ;
(4)白色固体X中的物质有____________________ ;
(5)将白色固体X转化成氯化钠固体的实验方案是_______________________________。
【答案】 CuSO4 CaCO3 + 2HCl == CaCl2 + H2O +CO2↑ CaCl2 + Na2CO3 == CaCO3 ↓ + 2NaCl NaCl、CaCl2、CaCO3 加水溶解,加入适量的Na2CO3溶液,过滤,向滤液中滴加稀盐酸至不在产生气泡,后蒸发溶液,当有较多固体出现时,停止加热——得到氯化钠固体
【解析】(1)CuSO4 溶液是蓝色的,且氢氧化铜沉淀也是蓝色,根据步骤①实验现象确定白色固体X中一定没有CuSO4 (2).碳酸盐能与稀盐酸反应生成气体,故步骤②中的白色沉淀是碳酸钙,反应的化学方程式为: CaCO3 + 2HCl == CaCl2 + H2O +CO2↑ (3).据题意,白色固体中无硫酸铜,一定有碳酸钙,无色溶液与碳酸钠溶液反应生成白色沉淀,所得溶液的PH=7,则白色固体中含有氯化钙,不含氢氧化钙,故步骤③中产生白色沉淀A的化学方程式为:CaCl2 + Na2CO3 == CaCO3 ↓ + 2NaCl (4).白色固体X中的物质有NaCl、CaCl2、CaCO3 (5)将白色固体X转化成氯化钠固体的实验方案是: 加水溶解,加入适量的Na2CO3溶液,过滤,滤出碳酸钙,向滤液中滴加稀盐酸至不在产生气泡,以除去剩余的Na2CO3溶液,然后蒸发溶液,当有较多固体出现时,停止加热即得到氯化钠固体。

 名校课堂系列答案
名校课堂系列答案