题目内容
【题目】以甲为原料合成化工产品丁的微观过程如图。下列说法正确的是( )
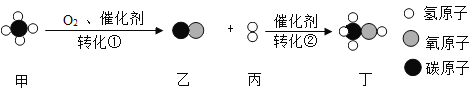
A. 甲的化学符号是CH4,甲的一个分子中含有两个氢分子
B. 丙的化学符号是H2 ,保持丙的化学性质的最小粒子是原子
C. 转化①属于分解反应,转化②属于化合反应
D. 转化①属于氧化反应
【答案】D
【解析】
由物质的微观构成可知,甲烷为CH4、乙为CO、丙为H2、丁为CH3OH,反应①②的方程式分别为:2CH4+O2 2CO+4H2、CO+2H2
2CO+4H2、CO+2H2 CH3OH。
CH3OH。
A、甲是甲烷,化学式为CH4,一个甲烷分子中含有4个氢原子,故错误;
B、丙是氢气,化学符号是H2 ,保持氢气的化学性质的最小粒子是氢分子,故错误;
C、由①②的化学方程式可知,转化①不符合化合反应多变一的特点,不属于化合反应,转化②属于化合反应,故错误;
D、由①的化学方程式可知,转化①属于氧化反应,故正确。
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】(一)下图所示是一个具有刻度和活塞可滑动的玻璃容器,其中有空气和足量的白磷(白磷的着火点40摄氏度),将它放在盛有沸水的烧杯上方,进行试验。请完成下图所示实验报告。
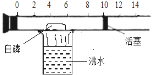
(1)实验目的:______________
(2)实验现象: ①玻璃容器内___________,②活塞_________ ,③活塞最后停在刻度______ 附近
(3)实验结论:空气的成分按体积计算,氧气约占空气体积的五分之一。
(二)学校化学兴趣小组的同学知道二氧化锰能作过氧化氢分解的催化剂以后,想再探究其他一些物质如氧化铝(Al2O3)是否也可作过氧化氢分解的催化剂。请你一起参与他们的探究过程,并填写下列空白:
(1)〔问题〕Al2O3能不能作过氧化氢分解的催化剂呢?
(2)〔猜想〕Al2O3能作过氧化氢分解的催化剂。
(3)〔实验验证〕
实验步骤 | 实验现象 | 实验结论 | |
实验一 | ____________ | 木条不复燃 | 常温下过氧化氢溶液的分解速率很慢 |
实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,将带火星的木条伸入试管中 | 木条复燃 | Al2O3能加快过氧化氢的分解速率 |
(4)〔结论〕Al2O3能加快过氧化氢的分解速率,故Al2O3能作过氧化氢分解的催化剂。
(5)〔讨论与反思〕经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验(实验三):
〔实验目的〕 探究_________。
〔实验步骤〕 ①准确称量少量Al2O3 的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤、洗涤、烘干、_________;④反应前后进行对比。
〔讨论〕如果Al2O3在反应前后_________不变,_______(“已能”或“还不能”)说明Al2O3可以作过氧化氢分解的催化剂。
理由是:_________