题目内容
构建知识框架是学习科学的重要方法,如图是初中科学金属的冶炼框架图(反应条件已省去)。已知甲、丁是最常见的固体金属,乙是常见的非金属固体,“→”表示反应的方向,请回答下列问题:
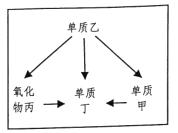
(1)单质乙是______;
(2)“单质甲→单质丁”表示湿法炼铜,请写出其化学方程式______;
(3)在冶炼金属丁的过程中,乙、丙的共同性质是______。
 阅读快车系列答案
阅读快车系列答案电影《我和我的祖国》中有这样一则片段:开国大典前夜, 升旗试验出了问题,旗杆顶部的阻断球因锈蚀变脆而折断,为保证当天升 旗成功,采用焊接方式换上新的不锈钢阻断球,最终升旗仪式完美无缺。

(一)阻断球是常见的铁制品,工业上常用设备高炉来炼铁,主要原料是 焦炭、赤铁矿石(主要含 Fe2O3)、石灰石、空气等,主要反应过程如下:

请回答:
(1)将炼出的“铁”加足量盐酸,充分反应后,总有黑色物质剩余,该黑色物质为________填 化学式);
(2)反应②的化学方程式为_____,该反应所属的基本反应类型为_____。
(二)金属的锈蚀及防护
(1)铁质阻断球的生锈,实际上是铁与_______、_____________共同作用的结果。铁锈的颜色是______;下列情况下铁制品最易生锈的是______(填序号).
a 潮湿空气中 b 干燥空气中 c 部分浸入食盐水中
(2)生活中的铁制品琳琅满目,铁还可以作铁锅利用了铁的_______性,请写出一种生活中防止铁锅生锈的方法:_______。
(3)金属铝比铁活泼,却具有很好的抗腐蚀性,原因是_____________ (用方程式表示)
(三)铁锈组成分析测定
(查阅资料)铁锈成分复杂,化学式可简单表示为 Fe2O3•nH2O,在加热时会分步反应,首 先失去结晶水,其反应可表示为 Fe2O3•nH2O Fe2O3+nH2O。浓硫酸可以吸水,碱石灰 可以吸收水和二氧化碳。
Fe2O3+nH2O。浓硫酸可以吸水,碱石灰 可以吸收水和二氧化碳。
(提出问题)铁锈(Fe2O3•nH2O)中 n 的值等于多少呢?
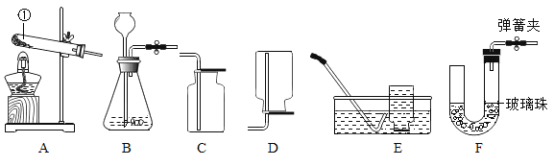
(问题探究)为了探究铁锈(Fe2O3•nH2O)的组成,称取 30.0g 部分生锈的铁粉样品,样品中仅含铁和 Fe2O3•nH2O,按如图 2 所示装置进行实验。

(1)为了保证实验安全,实验开始时应先通 CO,目的是_______;
(2)反应结束后还需持续通 CO,除了防止铁氧化以外,还有_______ 的目的。
(3)实验结束后,A 中玻璃管内出现的现象是_______ ;
(4)请指出该装置中有一处明显不足_______ ;
(数据处理)图 3 是加热时间和 A 中固体质量关系图象,下表是 B、C 中质量不再变化时 B中浓硫酸、C 中碱石灰装置质量变化情况。

反应前(g) | 反应后(g) | |
B | 100 | 105.4 |
C | 150.0 | 163.2 |
(5)完全反应产生的二氧化碳质量为_______ ;铁锈(Fe2O3•nH2O)中 n 的值是______;
(6)写出 T3-T4 时间段所发生的化学方程式_______
(7)计算 30g 样品中单质铁的质量分数_______。(写出计算过程,结果保留到 0.1%)