题目内容
【题目】炼铁的原理是利用一氧化碳与氧化铁反应,某同学利用该原理设计了一个实验,实验装置见下图。
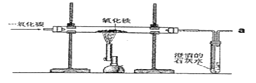
请你对实验进行分析并回答:
(1)该实验利用了CO的______性;给玻璃管加热的仪器叫_________。
(2)玻璃管中的现象是____________,反应的化学方程式是_____________ 。
(3)实验前先_______(填“通入 CO”;“加热”)实验后先________,(填“停止通入 CO”;“停止加热”)这样做的原因是(答一点)________________。
(4)实验要在装置末端 a 处燃着一盏酒精灯,其作用是_______________ 。
【答案】 酒精喷灯 外焰 固体粉末由红棕色逐渐变为黑色 3CO+Fe2O3 ![]() 2Fe+3CO2 通入CO 停止加热 除去装置中的空气,以免加热时装置发生爆炸(或作保护气,以免生成的铁在高温下被氧化) 除去尾气中的一氧化碳,以免一氧化碳污染空气
2Fe+3CO2 通入CO 停止加热 除去装置中的空气,以免加热时装置发生爆炸(或作保护气,以免生成的铁在高温下被氧化) 除去尾气中的一氧化碳,以免一氧化碳污染空气
【解析】(1)一氧化碳具有还原性,可以冶炼金属;该实验中给玻璃管加热的仪器是酒精喷灯;
(2)玻璃管中看到的现象是固体粉末由红棕色逐渐变为黑色;该反应是一氧化碳与三氧化二铁在加热的条件下反应生成铁和二氧化碳,反应方程式为:3CO+Fe2O3 ![]() 2Fe+3CO2;
2Fe+3CO2;
(3)一氧化碳具有可燃性,当有氧气,温度达到着火点时就会剧烈燃烧,引起爆炸,故应该先通入一段时间一氧化碳,排尽管中的空气,后点燃酒精灯,当实验结束时,为了防止铁被氧化,应该先停止加热待温度冷却后停气;
(5)一氧化碳是有毒的气体,不能直接排放在空气中,故在a处加装酒精灯是为了燃烧一氧化碳,防止污染空气;

【题目】某化学兴趣小组的学生,发现金属R不在初中学到的金属活动性顺序表中,该小组为了了解R与常见金属铝、铜的金属活动性顺序,进行如下探究活动:
【作出猜想】他们考虑到铝的活动性比铜强,对三种金属的活动性顺序作出如下猜想:
猜想一:Al>Cu>R,猜想二:________________,猜想三:R>Al>Cu。
【查阅资料】R是一种银白色的金属,RSO4溶液呈蓝色;常温下铝的表面会形成一层致密的氧化膜;硫酸铝、氯化铝、硝酸铝的溶液均为无色。
【实验探究】为了探究哪一种猜想成立,甲、乙、丙三位同学分别针对猜想一、猜想二、猜想三设计实验方案并展开实验探究。
猜想 | 主要操作 | 主要现象 | 实验结论 |
一 | 打磨R丝,并将其插入到硫酸铜溶液中 | R丝表面覆盖了一层红色的物质 | 猜想一________(“成立”或“不成立”) |
二 | 打磨粗细相同的R丝、铝丝、铜丝,分别将它们插入到体积相同、溶质质量分数也相同的稀硫酸中 | ①R丝表面产生气泡缓慢,溶液由无色逐渐变成蓝色 ②铝丝表面产生气泡较快 ③铜丝表面没有气泡产生 | 猜想二成立 |
三 | 把铝丝插入RSO4溶液中 | ________________ | 猜想三成立 |
【交流反思】究竟哪种猜想成立?三位同学经讨论交流,发现丙同学在实验前没有打磨铝丝,这可能会导致实验结论错误。于是他们先打磨铝丝,再将其插入到RSO4溶液中,一段时间后,溶液的颜色由________色变为________色;进而确认猜想三不成立,猜想二成立。写出Al与稀硫酸反应的化学方程式:____________________________。
【归纳总结】探究结束后,他们总结得出:通过金属与酸反应或金属与盐溶液反应可以比较金属活动性强弱。