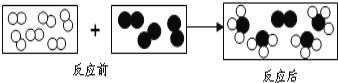
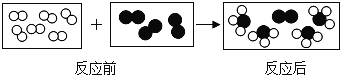
题目内容
【题目】某化学小组测定空气中氧气的体积分数。
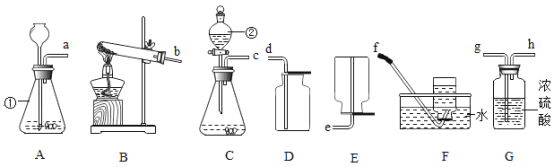
(1)根据如图回答问题。
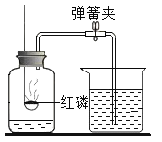
①红磷燃烧的化学方程式为_______________________。
②实验过程中发现实验结果偏大,下列原因正确的是(________________)
A 红磷过量 B 装置气密性不好 C 将燃着的红磷缓慢伸入瓶内
D 未等装置冷却就打开弹簧夹 E 瓶内预先装了少量水
(2)用四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数。反应原理为:2Na2S4+O2+2H2O=8S![]() +4NaOH(氢氧化钠)。小资料:四硫化钠(Na2S4)与氧气、水反应生成难溶于水的固体硫(S)和易溶于水的氢氧化钠。
+4NaOH(氢氧化钠)。小资料:四硫化钠(Na2S4)与氧气、水反应生成难溶于水的固体硫(S)和易溶于水的氢氧化钠。
(实验过程):
①取足量的四硫化钠固体加入试管中,再加入适量的水,迅速塞紧橡胶塞,充分振荡。测量液面至橡胶塞下沿的距离,记录数据h1(如图1所示)。
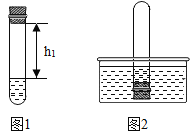
②将该试管插入水中(如图2所示),拔下橡胶塞,观察到_____________________,塞紧橡胶塞。将试管取出,倒转过来,测量液面至橡胶塞下沿的距离,记录数据h2。理论上h2:h1=______。
③按照①和②再重复实验2次、3次实验数据如下表所示.根据第三次实验数据,计算空气中氧气的体积分数为________%(结果精确到0.1%)
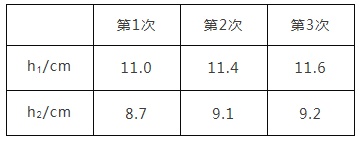
④若该实验中实际消耗的Na2S4质量为10g,则理论上生成的硫的质量为______g(计算结果保留两位小数)
【答案】![]() C 水进入试管内,进入水的体积约为试管内空气体积的五分之一 4∶5 20.7% 7.36
C 水进入试管内,进入水的体积约为试管内空气体积的五分之一 4∶5 20.7% 7.36
【解析】
解:(1) ①红磷燃烧生成五氧化二磷,反应的化学方程式为:![]() ;
;
②A、红磷过量可以是氧气消耗完,因此测得氧气的体积分数为五分之一,不符合题意;
B、实验装置若漏气,会使空气进入集气瓶内,因此测得氧气的体积分数小于五分之一,不符合题意;
C、将燃着的红磷缓慢伸入瓶内,塞紧瓶塞之前,瓶内部分空气受热逸出,因此测定氧气体积分数增大,符合题意;
D、未等装置冷却就打开弹簧夹,能够导致进入集气瓶中的水不到集气瓶容积的五分之一,因此测得氧气的体积分数小于五分之一,不符合题意;
E、红磷和氧气在点燃的条件下生成五氧化二磷,五氧化二磷会污染空气,会与水反应,所以集气瓶中预先加入少量水的作用是:降温,吸收生成的白烟五氧化二磷,防止造成空气污染,对结果无影响,不符合题意。故实验过程中发现实验结果偏大,原因正确的是选C。
(2) ②四硫化钠和氧气、水反应生成硫和氢氧化钠,会使得试管内压强变小,将该试管插入水中,拔下橡胶塞,观察到水进入试管内,进入水的体积约为试管内空气体积的五分之一;空气中氧气约占空气体积的五分之一,将试管取出,倒转过来,测量液面至橡胶塞下沿的距离,记录数据h2,理论上h2∶h1=4∶5;
③空气中氧气的体积分数=![]() ×100%=20.7%;
×100%=20.7%;
④若该实验中消耗的Na2S4质量为10g,则理论上生成的硫的质量为:10g×![]() ×100%=7.36g。
×100%=7.36g。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案