题目内容
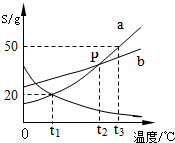 如图是a、b、c三种物质的溶解度曲线,a与b的溶解度曲线相交于P点.据图回答:
如图是a、b、c三种物质的溶解度曲线,a与b的溶解度曲线相交于P点.据图回答:(1)P点的含义是
(2)t3℃时30g a物质加入到50g水中不断搅拌,能形成80g溶液吗?
(3)t3℃时a、b、c三种物质的溶解度按由小到大的顺序排列是
(4)将t1℃时a、b、c三种物质饱和溶液的温度升高到t3℃时,三种溶液的溶质质量分数大小关系是
A.c>a=b B.a=b>c C.a>b>c D.b>a>c.
考点:固体溶解度曲线及其作用,溶质的质量分数、溶解性和溶解度的关系
专题:溶液、浊液与溶解度
分析:(1)溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)根据t3℃时a物质的溶解度50g进行解答;
(3)根据溶解度曲线可以比较同一温度时不同物质的溶解度大小;
(4)根据物质的溶解度随温度变化情况及饱和溶液中溶质的质量分数分析解答.
(2)根据t3℃时a物质的溶解度50g进行解答;
(3)根据溶解度曲线可以比较同一温度时不同物质的溶解度大小;
(4)根据物质的溶解度随温度变化情况及饱和溶液中溶质的质量分数分析解答.
解答:解:
(1)从溶解度曲线图不难看出,P点是a、b两曲线的交点,即两物质在t2℃时ab溶解度相等;
(2)t3℃时a物质的溶解度50g,100g水中溶解50g,所以t3℃时30g的a物质加入到50g水中不断搅拌,只能溶解25ga物质,所以形成溶液的质量为75g;故填:不能;
(3)t3℃时a、b、c三种物质的溶解度按由小到大的顺序排列是cba;
(4)ab的溶解度随温度升高而增大,c的溶解度随温度升高而减小,所以将t1℃时a、b、c三种物质的饱和溶液升温至t3℃时,c析出晶体,溶质的质量分数减小,ab的溶解度变大,溶质、溶剂的质量不变,所以溶质的质量分数与降温前相等;饱和溶液中溶质的质量分数的计算式
×100%,可知溶解度大则溶质的质量分数大,而t1℃时b的溶解度大于a的溶解度,t1℃时a的溶解度大于于t3℃时c的溶解度,所以此时a、b、c三种物质的溶液的溶质质量分数大小关系是b>a>c.
答案:
(1)在t2℃时ab溶解度相等
(2)不能
(3)cba
(4)D
(1)从溶解度曲线图不难看出,P点是a、b两曲线的交点,即两物质在t2℃时ab溶解度相等;
(2)t3℃时a物质的溶解度50g,100g水中溶解50g,所以t3℃时30g的a物质加入到50g水中不断搅拌,只能溶解25ga物质,所以形成溶液的质量为75g;故填:不能;
(3)t3℃时a、b、c三种物质的溶解度按由小到大的顺序排列是cba;
(4)ab的溶解度随温度升高而增大,c的溶解度随温度升高而减小,所以将t1℃时a、b、c三种物质的饱和溶液升温至t3℃时,c析出晶体,溶质的质量分数减小,ab的溶解度变大,溶质、溶剂的质量不变,所以溶质的质量分数与降温前相等;饱和溶液中溶质的质量分数的计算式
| 溶解度 |
| 溶解度+100g |
答案:
(1)在t2℃时ab溶解度相等
(2)不能
(3)cba
(4)D
点评:本题难度不大,主要考查了溶解度曲线的意义、饱和溶液和不饱和溶液的转化,能较好的培养学生分析、解决问题的能力.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
若对化学反应X+Na2CO3=2Y+CaCO3↓进行合理的分析,下列分析结果中有错误的是( )
| A、X中一定含有钙离子 |
| B、X中阴离子化合价是-2价 |
| C、Y中一定含有钠元素 |
| D、该反应属于复分解反应 |