题目内容
(2009?苏州)酸与碱之间发生中和反应,其实质是酸溶液中大量自由移动的H+和碱溶液中大量自由移动的OH-结合成水分子的过程.请根据以下氢氧化钠溶液与稀盐酸反应的实验,回答问题.实验1用酚酞试液
(1)向一锥形瓶中倾倒20g质量分数为4.00%的氢氧化钠溶液,滴入3滴酚酞试液,振荡,再逐滴滴入质量分数为3.65%的稀盐酸,边滴边振荡,直至溶液刚好变为______色为止,共用去稀盐酸20g,则反应后溶液中溶质质量分数为______(结果精确到0.1%).反应后溶液中的溶质可用______的方法(填一操作名称)使其析出.用酚酞作指示剂可逐滴控制酸、碱溶液反应的量,视觉效果灵敏,操作简便.
实验2用pH试纸
(2)向一支试管内倒入约2mL氢氧化钠溶液,再逐滴滴入盐酸,边滴边振荡.然后用玻璃棒蘸取反应液沾到pH试纸上,与标准比色卡对照.因无法通过肉眼观察到反应进程,需间隔数滴多次检测溶液的pH,所以每使用玻璃棒蘸取溶液前,必须进行______的预处理.
小 结
(3)除了用酸碱指示剂、pH试纸外,还可用______(填方法)检测中和反应是否发生.
【答案】分析:氢氧化钠与盐酸反应生成的氯化钠可以通过蒸发的方法使其析出,用PH试纸测定溶液的PH,使用的玻璃棒必须保证洁净,中和反应是放热反应,可以通过测温度的方法检验.
解答:解:(1)氢氧化钠和盐酸恰好完全反应时溶液呈中性,酚酞恰好变为无色,设生成氯化钠的质量为x,则有
NaOH+HCl=NaCl+H2O
40 58.5
20g×4.00% x
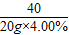 =
=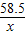
x=1.17g
所以反应后溶液中溶质质量分数为: ×100%=2.9%,
×100%=2.9%,
要使氯化钠析出,可以使用蒸发的方法,所以本题答案为:无,2.9%,蒸发结晶(或蒸发);
(2)使用的玻璃棒必须保证洁净,所以本题答案为:洗净并擦干;
(3)中和反应是放热反应,可以通过测温度的方法检验测温度变化.
点评:本题考查了氢氧化钠与盐酸的中和反应,完成此题,可以依据已有的知识进行.
解答:解:(1)氢氧化钠和盐酸恰好完全反应时溶液呈中性,酚酞恰好变为无色,设生成氯化钠的质量为x,则有
NaOH+HCl=NaCl+H2O
40 58.5
20g×4.00% x
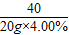 =
=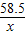
x=1.17g
所以反应后溶液中溶质质量分数为:
 ×100%=2.9%,
×100%=2.9%,要使氯化钠析出,可以使用蒸发的方法,所以本题答案为:无,2.9%,蒸发结晶(或蒸发);
(2)使用的玻璃棒必须保证洁净,所以本题答案为:洗净并擦干;
(3)中和反应是放热反应,可以通过测温度的方法检验测温度变化.
点评:本题考查了氢氧化钠与盐酸的中和反应,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
(2009?苏州)、某课外活动小组为了测定一批石灰石中碳酸钙的质量分数,将石灰石样品研成粉末,然后取一定量的石灰石粉末与过量稀盐酸充分反应(假设石灰石中的杂质既不和酸反应,也不溶于水),过滤、洗涤、干燥后称量滤渣质量的数据如下表:
(1)该样品中碳酸钙质量分数的平均值为:______(结果精确到0.1%).
(2)引起三次实验数据差异的操作原因可能是:______.
(3)若利用题(1)的结果,煅烧100t这种石灰石,理论上最多能得到氧化钙多少吨?(结果精确到0.1t)
| 实验序号 | 样品的质量/g | 滤渣的质量/g |
| 第一次 | 3.4 | 0.3 |
| 第二次 | 3.6 | 0.4 |
| 第三次 | 5.0 | 0.5 |
(2)引起三次实验数据差异的操作原因可能是:______.
(3)若利用题(1)的结果,煅烧100t这种石灰石,理论上最多能得到氧化钙多少吨?(结果精确到0.1t)
(2009?苏州)、某课外活动小组为了测定一批石灰石中碳酸钙的质量分数,将石灰石样品研成粉末,然后取一定量的石灰石粉末与过量稀盐酸充分反应(假设石灰石中的杂质既不和酸反应,也不溶于水),过滤、洗涤、干燥后称量滤渣质量的数据如下表:
(1)该样品中碳酸钙质量分数的平均值为:______(结果精确到0.1%).
(2)引起三次实验数据差异的操作原因可能是:______.
(3)若利用题(1)的结果,煅烧100t这种石灰石,理论上最多能得到氧化钙多少吨?(结果精确到0.1t)
| 实验序号 | 样品的质量/g | 滤渣的质量/g |
| 第一次 | 3.4 | 0.3 |
| 第二次 | 3.6 | 0.4 |
| 第三次 | 5.0 | 0.5 |
(2)引起三次实验数据差异的操作原因可能是:______.
(3)若利用题(1)的结果,煅烧100t这种石灰石,理论上最多能得到氧化钙多少吨?(结果精确到0.1t)
