题目内容
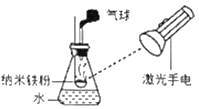
【题目】某兴趣小组同学用如图所示装置测定铜锌合金中铜的质量分数。

(实验准备)
(1)将铜锌合金用砂纸打磨,其目的是_____;
(实验步骤)
(2)实验操作有:
①记录量气管D的液面位置;
②检查气密性,将药品和水装入各仪器中,连接好装置;
③待B中不再有气体产生并恢复至室温后,记录量气管D的液面位置;
④由A向B中滴加足量试剂;
⑤将B中剩余固体过滤,洗涤,干燥,称重。
上述进行的操作的顺序是_____(填序号)
(3)B中发生反应的化学方程式为_____。
(定量计算)
(4)若实验中,打磨后铜锌合金样品质量为5g,与稀硫酸充分反应后,测得产生的气体体积为0.556L,该条件下氢气的密度为0.09g/L,则生成氢气的质量为_____g(结果保留两位小数);合金中铜的质量分数为多少_____?(写出计算过程)。
(分析讨论)
(5)小组同学交流发现上述方法测得的铜的质量分数会偏小,则下列选项中可能的原因有_____。
A.剩余固体中仍含有未反应的锌
B.生成氢气的体积包含了加入的稀硫酸体积
C.由于稀硫酸与锌粒反应放热,生成气体的温度高于常温,没有等气体恢复至室温就开始读数
D.反应后读数时,量气管液面高度高于左侧球形干燥管内液面的高度
【答案】除去表面的氧化物 ②①④③⑤ Zn+H2SO4═ZnSO4+H2↑ 0.05; 32.5% BC
【解析】
(1)将铜锌合金用砂纸打磨,其目的是除去表面的氧化物。
(2)上述进行的操作的顺序是:检查气密性,将药品和水装入各仪器中,连接好装置;记录量气管D的液面位置;由A向B中滴加足量试剂;待B中不再有气体产生并恢复至室温后,记录量气管D的液面位置;将B中剩余固体过滤,洗涤,干燥,称重。故填:②①④③⑤。
(3)B中锌和稀硫酸反应生成硫酸锌和氢气,发生反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑。
定量计算:
(4)解:生成氢气的质量为:0.09g/L×0.556L=0.05g;
设锌质量为x,
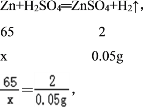
解得x=1.63g,
合金中铜的质量分数为:![]() ×100%
×100%![]() 32.5%,
32.5%,
答:合金中铜的质量分数为:32.5%,
(5)A、剩余固体中仍含有未反应的锌,会导致产生氢气质量偏小,从而导致计算的铜质量偏大,进一步导致计算的铜的质量分数偏大,不符合题意;
B、生成氢气的体积包含了加入的稀硫酸体积,导致产生氢气体积偏大,从而导致锌质量偏大,进一步导致计算的铜的质量分数偏小,符合题意;
C、由于稀硫酸与锌粒反应放热,生成气体的温度高于常温,没有等气体恢复至室温就开始读数,导致产生氢气体积偏大,从而导致锌质量偏大,进一步导致计算的铜的质量分数偏小,符合题意;
D、反应后读数时,量气管液面高度高于左侧球形干燥管内液面的高度,导致产生氢气体积偏小,从而导致计算的铜质量偏大,进一步导致计算的铜的质量分数偏大,不符合题意。故选BC。

 名校课堂系列答案
名校课堂系列答案