题目内容
【题目】某盐酸中混有少量的MgCl2,小明为了测定该盐酸混合液中HCl的质量分数,进行如下图实验:
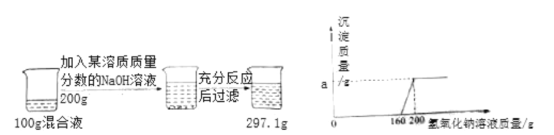
请结合上图实验数据,完成以下计算:
(1)HCl中氢、氯元素质量比为_________________(填最简整数比);
(2)坐标中a的数值为______________;
(3)所加NaOH溶液的溶质质量分数为________________;
(4)该盐酸混合液中HCl的质量分数(写出计算过程)。__________
【答案】 1:35.5=2:71; 2.9g; 10% 14.6%
【解析】
(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答;(2)根据质量守恒定律分析;(3)根据生成氢氧化镁的质量结合化学方程式计算所加NaOH溶液的溶质质量分数;(4)根据与盐酸反应的氢氧化钠溶液的质量计算氢氧化钠的质量,结合化学方程式计算混合液中HCl的质量分数。
(1)HCl中氢、氯元素质量比为:1:35.5=2:71;
(2)化学反应前后各物质的质量总和不变,故a=100+200297.1=2.9;
(3)根据图示可以看出,与氯化镁反应的氢氧化钠溶液的质量为200g160g=40g,设所加NaOH溶液的溶质质量分数为x,则有:
2NaOH+MgCl2═Mg(OH)2↓+2NaCl
80 58
40gx 2.9g
![]()
x=10%
所加NaOH溶液的溶质质量分数为10%;
(4)与盐酸反应的氢氧化钠溶液的质量为160g,设混合液中HCl的质量分数为y
HCl+NaOH═NaCl+H2O
36.5 40
100gy 160g×10%
![]()
y=14.6%
该盐酸混合液中HCl的质量分数14.6%。

练习册系列答案
相关题目