题目内容
【题目】(10分)人类的生产、生活离不开金属。
(1)目前世界上年产量最高的金属是 (填化学式) ;
(2)铁制品锈蚀,实际上是铁跟空气中的 发生了化学反应。防止铁制栏杆锈蚀的一种方法是 ;
(3)已知下列各组物质间均能发生置换反应。
A.Fe 和CuSO4 溶液
B.Mg和MnSO4 溶液
C.Mn和FeSO4 溶液
①写出Fe 和CuSO4 溶液反应的化学方程式 ;
②Mn、Fe、Mg、Cu四种金属的活动性由强到弱的顺序 。
(4)工业生产中常用10%的稀盐酸来除去铁制品表面的铁锈,实验室若要配制该盐酸200g,则需要溶质的质量分数为38%的浓盐酸 g(计算结果请保留至0.1g);实验室在配制10%的稀盐酸的过程中,除了用到烧杯、量筒和胶头滴管外,还需要用到的玻璃仪器是 。
(5)某化学小组在实验结束后,进行了如下废液处理:
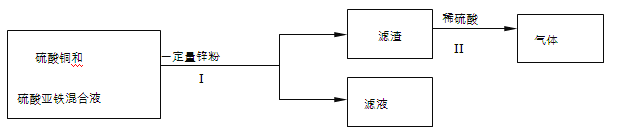
①Ⅰ中的操作名称是 ;
②写出Ⅱ中一定发生反应的化学方程式 ;
③滤液中溶质的组成可能是 (写出一种情况即可)。
【答案】(1)Fe;
(2)氧气和水蒸气;刷漆(或涂油,或镀其他金属);
(3)①![]() ; ②Mg>Mn>Fe>Cu;
; ②Mg>Mn>Fe>Cu;
(4)52.6;玻璃棒;
(5)①过滤; ② ![]() (或
(或![]() );
);
③![]() 或
或![]() 、
、![]() 或
或![]() 、
、![]() 、
、![]() .
.
【解析】
试题分析:(1)目前世界上年产量最高的金属是铁;
(2)铁锈蚀的条件是水和氧气,铁制品锈蚀,实际上是铁跟空气中的水蒸气和氧气发生了化学反应;防止铁制品生锈的方法有多种,如刷漆、涂油或镀其他金属;
(3)①![]() ;
;
②在金属的活动性顺序中,位置越靠前活动性越强;
在金属的活动性顺序中,位于前面的金属能把后面的金属从他们的化合物溶液中置换出来;
A.Fe和![]() 溶液反应,说明铁的活动性比铜强;B.Mg和
溶液反应,说明铁的活动性比铜强;B.Mg和![]() 溶液反应,说明镁的活动性比锰强;C.Mn和
溶液反应,说明镁的活动性比锰强;C.Mn和![]() 溶液反应,说明锰的活动性比铁强; Mn、Fe、Mg、Cu四种金属的活动性由强到弱的顺序Mg 、Mn、Fe、Cu;
溶液反应,说明锰的活动性比铁强; Mn、Fe、Mg、Cu四种金属的活动性由强到弱的顺序Mg 、Mn、Fe、Cu;
(4)溶液的稀释,稀释前后溶质的质量不变;
设需要溶质质量分数为38%浓盐酸的质量为x
![]() 解得x=52.6g;
解得x=52.6g;
实验室在配制10%的稀盐酸的过程中,除了用到烧杯、量筒和胶头滴管外,还需要用到的玻璃仪器是玻璃棒;
(5)①过滤是分离固体和液体混合物的方法,Ⅰ中的操作是过滤;
②滤渣能与稀硫酸反应放出气体,说明滤渣中的固体是活泼金属,铁或者是锌,所以反应的方程式可能为![]() ,
,
或![]() ;
;
③![]() ,
,![]() ;
;
由于加入锌的量未知,可以分为以下几种情况:
第一种情况,加入锌的量不能将硫酸铜完全反应,则只发生上面第一个反应,过滤后的滤液中含有硫酸铜、硫酸亚铁和硫酸锌;
第二种情况,加入锌的量不能将硫酸亚铁完全反应,则发生上面两个反应,过滤后的滤液中含有硫酸亚铁和硫酸锌;
第三种情况,加入锌的过量,则硫酸铜和硫酸亚铁完全反应,过滤后的滤液中只有硫酸锌.